细胞坏死受到多种信号通路的调节。通常把不依赖于caspase 活性的细胞死亡途径都归结为细胞坏死,根据研究显示,目前有两种信号通路介导的细胞坏死,分别为TNF-α 通过RIP3 介导的细胞坏死和PARP-1 过度激活引发AIF表达介导的细胞坏死。从以下描述我们可以看出,这两条通路既有各自不同的特点,又有交叉互作。
6.1.2.1 TNF-α 通过RIP3 介导的细胞坏死
结核分枝杆菌感染后,首先TNF-α 与细胞膜上的肿瘤坏死因子受体(TNFR)相结合,TNFRs 不具有酶的活性,当与TNF 结合后,可以募集TRADD、FADD 和受体相关蛋白(Receptor interacting protein,RIP)。受体相关蛋白家族有很多蛋白,其中受体相互作用蛋白1(RIP1)和受体相互作用蛋白3(RIP3)是细胞坏死信号通路中两种极为重要的调节蛋白。与RIP 家族其他成员不同,RIP3 与RIP1 有一段特殊的蛋白相互作用区域,两者相互作用使RIP1 磷酸化,形成坏死诱导复合物。在很多情况下,细胞凋亡和细胞坏死是共存的,并且可以发生转化。如TNF-α、FasL 等可诱发细胞凋亡,也可诱发细胞坏死,RIP3 作为一个分子开关可转换细胞的死亡方式。RIP3 虽然不影响RIP1 介导的细胞凋亡过程,但是它能影响RIP1 介导的坏死。当Caspase 被阻断或Caspase 依赖的通路不能被正常激活时,细胞坏死会作为替补的死亡方式发生。也就是说RIP1 是决定细胞生存和死亡的交叉点,而RIP3 则是决定细胞死亡方式的转换器。
根据韩家淮等人2009年的研究报道发现,RIP3 是TNF-α 诱导的两株NIH-3T3 细胞选择不同死亡方式的主要原因。RIP3 可以促进下游蛋白激酶,如糖原磷酸化酶、谷氨酰胺合成酶和谷氨酸脱氢酶的相互作用,并提高下游蛋白酶活性,这些酶通过参与三羧酸循环产生过量的具有细胞毒性的活性氧(图6-4),而线粒体上迅速产生并积累的ROS 介导了TNF 诱导的Caspase非依赖型的细胞坏死。
后来,王晓东教授团队在对细胞坏死的研究中发现(图6-5),混合谱系激酶域样蛋白(Mixed Lineage Kinase Domain-like Protein,MLKL)通过与RIP3 结合并使其发生磷酸化,在TNF-α 诱导的坏死过程中发挥了重要的作用,而MLKL 与RIP3 和RIP1 结合后357 位的苏氨酸和358 位的丝氨酸被RIP3 磷酸化是细胞坏死小体被激活的标志。这也就证实了MLKL 是RIP3 激酶下游坏死信号的关键调控因子。

图6-4 TNF-α 介导的细胞程序性坏死途径( 引自Duanwu Zhang, et al. 并重绘)(https://www.xing528.com)
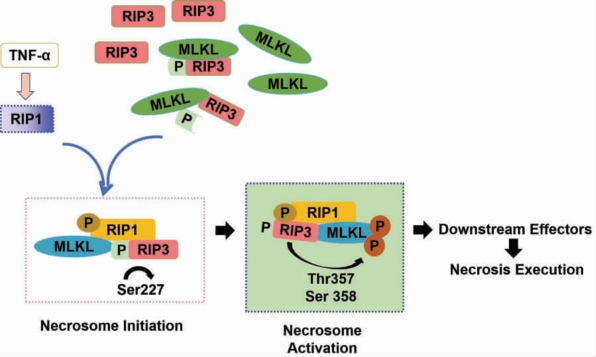
图6-5 MLKL 参与细胞坏死小体的作用机制( 引自Liming Sun, et al. 并重绘)
6.1.2.2 PARP-1 介导的细胞坏死
如图6-6 所示,除了RIP3 介导的细胞坏死外,当细胞受损伤时,DNA 结构会被破坏,导致细胞内PARP-1 异常激活,同时线粒体机能失调,细胞凋亡诱导因子(AIF)从线粒体膜间隙中释放出来,并进入细胞核中,就会造成DNA 的损伤和PARP-1 的过度激活,而PARP-1 的激活又进一步促进AIF的释放。同时PARP-1 的激活还可促进线粒体产生ROS,ROS 的过度积累又会破坏DNA 反向激活PARP-1,如此周而复始造成恶性循环,导致细胞坏死。由此可以看出,PARP-1 的激活最终导致细胞内NAD+减少,ATP 降低,细胞能量耗竭,加速细胞的坏死。实际上PARP-1 诱导的细胞死亡最早被认为是细胞凋亡,但是最近根据细胞死亡特征把PARP-1 和AIF 介导的细胞死亡归类为细胞坏死。
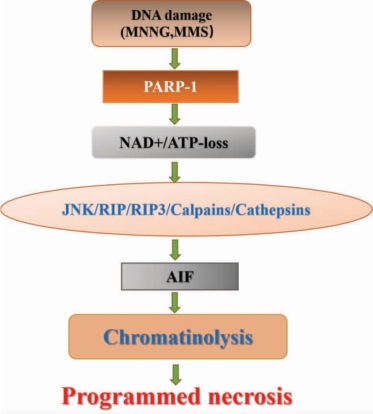
图6-6 PARP-1 介导的细胞程序性坏死途径( 引自Sosna J, et al. 并重绘)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




