由图3-1 可以看出,经典途径由多种免疫受体的信号触发,首先,由TGF-β 激活激酶1(TAK1),之后,TAK1 通过磷酸化IKK β 激活三聚体IκB激酶(IKK)复合物。在这一过程中,由于不同的信号都会聚集到由催化和调节亚基组成的IκB 激酶复合物中,由此决定了IκB 激酶复合物在经典途径中的关键作用。该复合物由结构蛋白NF-κB 的必需调节亚基NEMO/IKKγ和两个催化亚基IKKα 和IKKβ 组成。为了应对相应的刺激,IκB 激酶复合物使IκB 或p105 等IκB 家族成员磷酸化,导致IκBα 和p105 被靶向用于蛋白酶体中泛素(Ub)依赖性降解过程,与此同时诱导形成含有Rel A 和/或c-Rel的二聚体。之后,NF-κB 复合物从细胞质中释放,进入核内以驱动靶基因的表达,即发生核易位。遗传学证据表明,IKKγ 和IKKβ 对于介导磷酸化依赖性IκBα 脱位和经典NF-κB 核易位至关重要,而IKKα 似乎在激活经典NFκB 途径中只起到辅助作用。
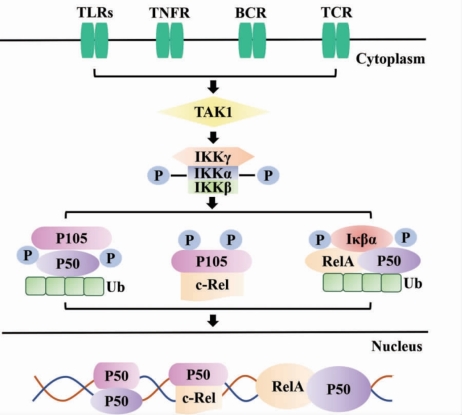
图3-1 经典NF-κB 信号传导途径(https://www.xing528.com)
虽然经典NF-κB 信号传导途径保护了静息状态滤泡B 细胞的功能完整性以及持久性,但在这些细胞发挥作用的过程中,经典NF-κ B 信号途径的缺失(NEMO 或IKK2 的降解)只是轻微影响了稳态下的细胞数量,这就与在成熟B 细胞中这两种分子缺失产生的影响形成了鲜明对比。这种差异可能反映了经典NF-κB 信号传导途径在B 细胞成熟过程中的关键意义。除此之外,与造血干细胞(HSC)相关的研究中经典NF-κB 也发挥了重要作用:在HSC 中,NF-κB 功能的丧失与获得均可导致HSC 受损,增殖能力降低。同时,肿瘤坏死因子α(TNF-α)、Toll 样受体(TLR)、配体和衍生自病毒或合成类似物的dsRNA 均可激活经典NF-κB 途径。Takayuki Abe 等人证明与STING 相关的TANK 结合激酶1(TBK1)有助于dsDNA 介导的NF-κB 和IRF3 的经典激活途径,从而介导促炎因子发生转录。推测其可能主要通过IKKα、β 激活环响应STING 配体来控制NF-κB 信号。此外,TRAF6 也可能参与调控了STING 介导的NF-κB 功能。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




