IgG 是机体最主要的抗体成分,也是体液免疫再次应答产生的最主要抗体类型,其含量占到了血清抗体含量80%左右。IgG 在机体内分布广泛并且与抗原亲和力高,具有至关重要的免疫功能。根据IgCH 中二硫键的位置和数量等结构的差异,可以将IgG 分为IgG1、IgG2、IgG3 和IgG4。其中IgG1、IgG3 和IgG4 可以穿透胎盘屏障进入到婴儿体内,在新生儿抵抗感染的过程中起重要作用。研究显示,IgG 的转运是受体介导的主动运输过程,无论是在胎盘的转运,还是新生儿吸食乳汁后在小肠壁的吸收,IgG 都被证明是由新生儿Fc 受体(FcRn)分子所介导的主动运输过程。
由图1-5 可知,FcRn 是由两个亚基构成的异源二聚体,一个亚基的分子量是50 kDa,称为α 链。α 链与MHCI 类分子一样,由3 个胞外结构域(α1、α2 和α3)、一个跨膜结构域和44 个氨基酸形成的细胞质尾部组成。另外一个亚基的分子量是15 kDa,称为β2 微球蛋白(β2m),简称β 链,结合α链装配后β 链才能发挥转运作用。FcRn 有两个主要的配体:IgG 和白蛋白。其中IgG 包含两个Fc 结构域(如图1-5),通过对FcRn 与IgG 结合时的晶体结构分析显示,FcRn-IgG 之间是以2∶1 的形式即2 分子的FcRn 与1 分子的IgG 相互结合,此时形成的复合体能大幅度延长IgG 的半衰期。现已证实,FcRn 分子与IgG 的主要结合位点在IgG Fc 段CH2-CH3 之间的铰链区,此过程涉及几个重要的氨基酸残基。例如在人的FcRn 的αl 和α2 区域第135位亮氨酸、130 位天冬氨酸、131 位色氨酸、116 位谷氨酸、115 位谷氨酸和114 位异亮氨酸,这些氨基酸残基在FcRn 与IgG Fc 片段CH2-CH3 区域相互结合过程中起关键性作用。
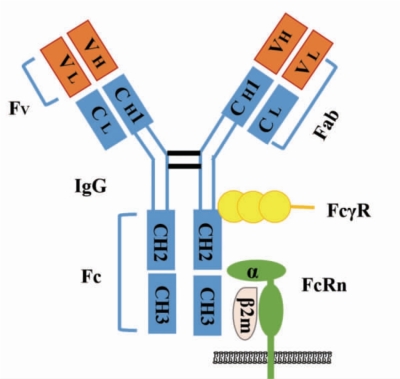
图1-5 IgG 与Fc 效应分子相互作用示意图( 引自Ward E S, Ober R J,并重绘)(https://www.xing528.com)
由于FcRn 结构的特殊性使得FcRn 在酸性条件下(pH 值为5.0~6.5)通过非重叠位点与IgG 结合(图1-6)。结合后FcRn 会将配体转运回细胞膜,再在细胞外液pH 值为7.4 时将配体重新释放。这种对pH 值依赖性的相互作用是由于FcRn 在CH2∶CH3 界面(H310 和H435)与两个组氨酸的结合而产生的,即在低pH 值时能够发生质子化反应。FcRn 与IgG 结合的这一特性对于FcRn 介导IgG 穿梭作用至关重要。例如在新生啮齿动物肠道中,弱酸性的胃液会携带IgG 进入十二指肠,在黏膜细胞上皮顶端结合FcRn,由FcRn携带IgG 穿过细胞到体液中,体液的中性环境会使FcRn 与IgG 解离,释放IgG,FcRn 分子则被母源侧细胞膜回收穿膜再利用。目前只有几种特殊情况能检测到FcRn 在中性环境下与IgG 配体相结合,例如小鼠的IgG2b 和部分人类的IgG3 中等位基因会在中性pH 值下与mFcRn 和hFcRn 表现出较弱的结合现象。
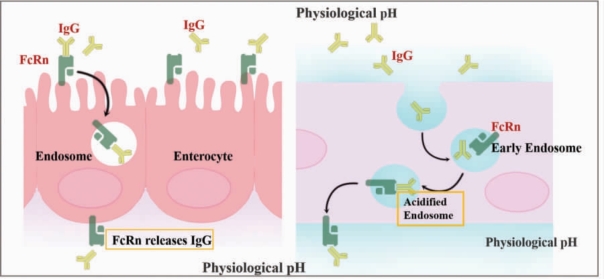
图1-6 FcRn 介导IgG 的转运( 引自Roopenian, D.C,并重绘)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




