4.1.4.1 ROS组分及抗氧化相关生理生化指标测定
样品匀浆液制备:称取0.2 g百子莲EC超低温保存不同阶段样品,在预冷的研钵中加入1.8 m L的0.1 mol/L磷酸缓冲液(p H 7.4)冰上研磨成浆,4℃下5000 rpm离心10 min,取上清液待测。
可溶性蛋白含量的测定应用考马斯亮蓝G-250法。
考马斯亮蓝G-250溶液配制:称取100 mg考马斯亮蓝G-250,溶于50 m L 90%乙醇中,加入100 m L 85%(w/v)磷酸,蒸馏水定容至1 L,贮于棕色瓶中。
标准蛋白质溶液(100μg/m L牛血清白蛋白)配制:称取牛血清白蛋白25 mg,加水溶解并定容至50 m L,吸取上述溶液20 m L用蒸馏水稀释至100 m L。
标准曲线绘制:取6只10 m L离心管,分别加入0、0.2、0.4、0.6、0.8、1.0 m L标准蛋白溶液,并用水定容至1 m L。混匀后各加入5 m L考马斯亮蓝G-250溶液,放置5 min后在595 nm下比色。以蛋白质浓度为横坐标,以吸光度值为纵坐标绘制标准曲线。标准曲线为A=0.0 066B+0.039(R 2=0.9 879)。
测定:取上清液0.1 m L于10 m L离心管中,加入0.9 m L双蒸水稀释并混匀,加入5 m L考马斯亮蓝G-250溶液,充分混合,放置2 min后于595 nm下测定吸光度,并通过标准曲线查得可溶性蛋白质含量。
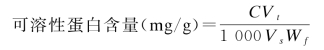
C——标准曲线值(μg)
V t——提取液总体积(m L)
W f——样品鲜重(g)
V s——测定时加样量(m L)
4.1.4.1.1 过氧化氢(H2 O2)含量的测定
按照测试盒说明书配制H 2 O2标准液后按操作步骤添加试剂,具体操作步骤如表4-1所示。
表4-1 过氧化氢(H2 O2)含量试剂盒操作步骤
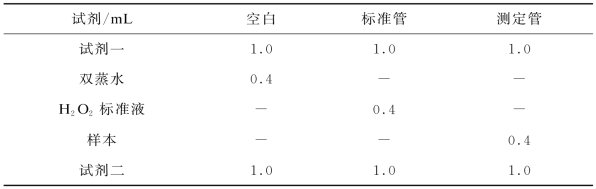
混匀,波长405 nm,光径1 cm,双蒸水调零,测定各管吸光度值。试剂要37℃预温10 min。计算公式如下,H2 O2标准液浓度为163μmol/L。
H 2 O2含量(μmol/gprot)=![]() ×标准品浓度+待测样本蛋白浓度(gprot/L)
×标准品浓度+待测样本蛋白浓度(gprot/L)
4.1.4.1.2 超氧化物歧化酶(SOD)活性的测定
按照说明书配制试剂一应用液、试剂四应用液及显色剂,按表4-2所示的操作步骤进行实验。
表4-2 超氧化物歧化酶(SOD)活性试剂盒操作步骤
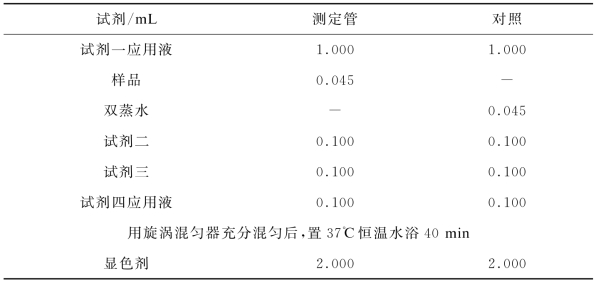
涡旋混匀,室温静置10 min。于波长550 nm,1 cm光径,双蒸水调零,测定各管吸光度值。计算公式如下:
SOD活性(U/mgprot)=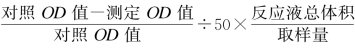 ÷待测样本蛋白浓度(mgprot/m L)
÷待测样本蛋白浓度(mgprot/m L)
4.1.4.1.3 过氧化物酶(POD)活性测定
按照说明书配制试剂二应用液、试剂三应用液。按表4-3所示步骤添加试剂。
表4-3 过氧化物酶(POD)活性试剂盒操作步骤

混匀,5 000 r/min离心10 min,取上清于波长420 nm,1 cm光径,双蒸水调零,测定各管吸光度值。计算公式如下:
POD活力(U/mgprot)=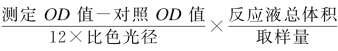 ÷反应时间÷待测样本蛋白浓度(mgprot/L)×1 000
÷反应时间÷待测样本蛋白浓度(mgprot/L)×1 000
4.1.4.1.4 过氧化氢酶(CAT)活性的测定
按照说明书配制试剂三,按表4-4所示步骤添加试剂。
表4-4 过氧化氢酶(CAT)活性试剂盒操作步骤

(续表)

混匀,波长405 nm,光径0.5 cm,双蒸水调零,测定各管吸光度值。试剂一、试剂二需要在37℃水浴中预温5 min。计算公式如下:
CAT活力(U/mgprot)=(对照OD值-测定OD值)×271×![]() ÷待测样品蛋白浓度(mgprot/m L)
÷待测样品蛋白浓度(mgprot/m L)
4.1.4.1.5 抗坏血酸(AsA)含量的测定
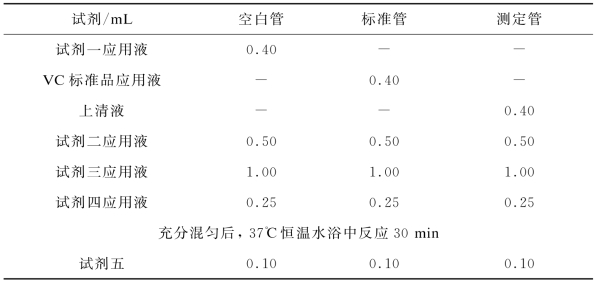
按照试剂盒说明书配制试剂一应用液、试剂二应用液、试剂三应用液、试剂四应用液及6μg/m L的VC标准品应用液。取0.15 m L样品匀浆液加入0.45 m L试剂一,涡旋混匀,放置15 min后5 000 r/min离心10 min,取上清液进行测定。按表4-5所示步骤添加试剂。
表4-5 抗坏血酸(AsA)含量试剂盒操作步骤
充分混匀,静置10 min,波长536 nm,光径1 cm,双蒸水调零,测定各管吸光度值。计算公式如下:
VC含量(μg/mgprot)=![]() ×标准品浓度×4÷待测匀浆蛋白浓度(mgprot/m L)
×标准品浓度×4÷待测匀浆蛋白浓度(mgprot/m L)
4.1.4.1.6 还原型谷胱甘肽(GSH)含量的测定
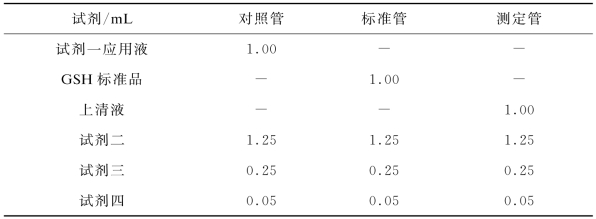
按照试剂盒说明书,配制试剂一应用液、试剂二、试剂三、试剂四及20 μmol/L的GSH标准液。取0.5 m L样本匀浆液加入2 m L试剂一,混匀后5 000 r/mim离心10 min,取上清液进行测定。按表4-6所示步骤添加试剂。
表4-6 还原型谷胱甘肽(GSH)含量试剂盒操作步骤
混匀,静置5 min,420 nm处,1 cm光径,双蒸水调零,测定各管吸光度。
计算公式如下:
GSH含量(mg GSH/gprot)= ×标准品浓度×307×5÷待测匀浆蛋白浓度(gprot/L)
×标准品浓度×307×5÷待测匀浆蛋白浓度(gprot/L)
4.1.4.2 碳纳米管对超低温保存过程中氧化胁迫损伤的影响
4.1.4.2.1 丙二醛(MDA)含量的测定
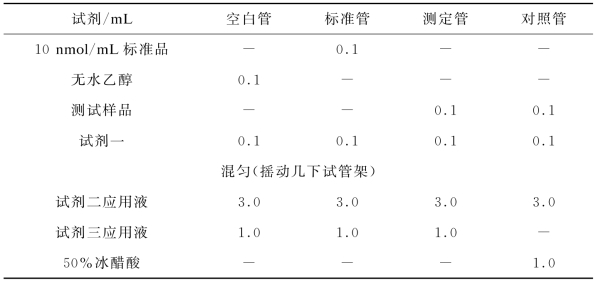
按照说明书指导,配制试剂二应用液和试剂三应用液。按表4-7所示步骤添加试剂。
表4-7 丙二醛(MDA)测定试剂盒操作步骤
 (https://www.xing528.com)
(https://www.xing528.com)
旋涡混匀器混匀,试管口用保鲜膜扎紧防止加热时液体蒸发损失,95℃水浴(或用锅开盖煮沸)80 min,取出后流水冷却,然后5 000 r/min,离心10 min,取上清液,532 nm处,1 cm光径,双蒸水调零,测定各管吸光度值。计算公式如下。
MDA含量(nmol/mgprot)= ×标准品浓度÷待测样品蛋白浓度(mgprot/m L)
×标准品浓度÷待测样品蛋白浓度(mgprot/m L)
4.1.4.2.2 相对电导率测定
取0.2 g百子莲EC样品,用去离子水冲洗后吸干水分,将吸干的样品放入100 m L烧杯中,加入40 m L去离子水,25℃浸泡两小时后,用电导率仪测定电导率R;用保鲜膜封口,沸水浴15 min,冷却至25℃,摇匀,测定电导率R 0。
![]()
4.1.4.3 氧化胁迫响应相关基因的表达水平分析
4.1.4.3.1 RNA提取与纯化
1)RNA提取
(1)取0.1 g百子莲EC置于研钵中,加入液氮研磨至粉末状,立即加入600μL Buffer RL,快速研磨使Buffer RL覆盖样品;室温放置至样品开始融化后立即快速研磨至样品完全融化;将1 m L枪头剪掉1~2 mm,吸取550μL溶液转入事先置于2 m L离心管内的预过滤柱-RD。
(2)7 000 g离心30 s,丢弃预过滤柱-RD。
(3)在上一步的滤液中加入300μL Buffer RBP;用试剂盒携带的1 m L枪头缓慢吹吸五次,吸取全部溶液;将1 m L枪头紧插在过滤枪头,缓慢吹打使溶液滤过滴入事先置于收集管中的RNA吸附柱-A。
(4)12 000 g离心2 min,弃废液,将RNA吸附柱-A放回收集管中。
(5)加入500μL Buffer WAR,12 000 g离心1 min,弃收集管,将RNA吸附柱-A放入另一个干净的收集管中。
(6)加入500μL Buf fer WD,12 000 g离心1 min,弃废液,将RNA吸附柱-A放回收集管中。
(7)加入700μL Buffer RW2,12 000 g离心1 min,弃废液,将RNA吸附柱-A放回收集管中。
(8)加入100μL无水乙醇,离心2 min。
(9)将RNA吸附柱-A转入试剂盒携带的1.5 m L离心管中,在硅胶模中央加15μL dd H 2 O,离心1 min。
2)RNA完整性及质量检测
取5μL RNA样品加入含1%琼脂糖的凝胶中电泳分析,电泳缓冲液为1×TAE,120 V电泳30 min,检测RNA的带型,观察RNA的完整性。另取1μL RNA样品,用Nano Drop 1 000微量紫外分光光度计检测RNA浓度和质量。
3)总RNA纯化
为防止基因组DNA和蛋白质、盐类物质影响后续试验结果,建立RNA纯化体系(见表4-8)。
表4-8 RNA纯化体系配制

(续表)

(1)在1.5 m L的RNase-free离心管中加入上述反应体系,混匀后在37℃中水浴30 min。
(2)加入50μL RNase-free水将体系定容至100μL,然后加入等体积的苯酚/氯仿/异戊醇(25∶24∶1),混匀。
(3)室温下,13 500 g离心5 min,将上清液小心地移至新管中。
(4)加入等体积的氯仿/异戊醇(24∶1),混匀。
(5)室温下,13 500 g离心5 min,将上清液小心地移至新管中。
(6)加入10μL 3 mol/L醋酸钠和250μL预冷的乙醇,冰上放置10 min。
(7)13,500 g 4℃离心15 min,弃上清。
(8)加入70%预冷的乙醇小心洗净沉淀及管壁,13 500 g 4℃离心5 min,弃上清。
(9)室温干燥沉淀5 min,加入适量65℃预热的RNase-free水溶解沉淀,待RNA沉淀完全溶解后于-80℃保存待用。
4)RNA完整性及质量检测
取5μL RNA样品加入到含1%琼脂糖的凝胶中电泳分析,电泳缓冲液为1×TAE,120 V电泳30 min,检测RNA的带型,观察RNA的完整性。另取1μL RNA样品,用Nano Drop 1 000微量紫外分光光度计检测RNA浓度和质量。
4.1.4.3.2 c DNA制备
在进行c DNA合成反应前,将纯化后的RNA溶液于65℃水浴加热5 min后迅速置于冰中2 min。
(1)在微量离心管中配制反应液,如表4-9a所示。
(2)离心数秒使模版RNA、引物等的混合液聚集于微量离心管底部。
(3)在微量离心管中配制逆转录反应液,如表4-9b所示。
(4)混合均匀,室温放置10 min后,移至42℃恒温水浴中反应1 h。反应结束后在70℃水浴加热10 min,并放置于冰上冷却2 min,-20℃保存待用。
表4-9a 反转录体系配制

表4-9b 反转录体系配制

4.1.4.3.3 定量分析氧化胁迫相关基因的q RT-PCR差异表达
1)引物设计与合成
百子莲基因序列目前没有文献报道可以参考,根据本实验室百子莲转录组分析结果,通过NCBI网站的UniGene数据库(http://www.ncbi.nlm.nih.gov/unigene)进行基因比对及匹配,选取保守序列区域,并结合Beacon Designer 7.0软件设计目标基因引物,引物列表如附录1所示。
利用Beacon Designer 7.0软件进行引物设计,选取80分以上的引物对并进行合成。合成的引物首先进行PCR扩增检测扩增效果,并利用实时荧光定量PCR检测引物特异性及目的基因扩增效率。引物由上海生工生物工程有限公司合成。
2)反应体系及程序
q RT-PCR扩增体系中包括:稀释25倍的c DNA原液为模板,SYBR Premix EX Taq II(2×)10μL,Forward Primer(10μmol/L)0.5μL,Reverse Primer(10μmol/L)0.5μL,dd H 2 O补齐至20μL,每个体系重复3次。反应程序为94℃变性3min,然后PCR扩增40个循环,每个循环包含94℃变性30 s,解链温度Tm复性30 s,72℃延长1 min。
3)数据分析方法
以Actin作为内参基因,以3次重复的几何平均值作为参照值。基因表达量的值应用2-ΔΔCt计算。其中ΔΔCt=Δ[(Ct 1-Ct 0)treated-(Ct 1-Ct 0)control](1代表目标基因,0代表内参基因)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




