玻璃化法(vitrification)超低温保存是将材料置于由一定比例渗透性和非渗透性保护剂组成的玻璃化溶液(plant vitrification solution,PVS)中,使细胞逐渐脱水并不断提高胞质黏度,在快速降温过程中细胞及其玻璃化溶液过冷至玻璃化转变温度(glass transition temperature,Tg),从而被固化成玻璃态(非晶态),以减少冰晶形成对细胞质膜产生致命性伤害,并以这种玻璃态在超低温下保存。
玻璃化法超低温保存包括以下步骤:①预培养(preculture);②渗透保护(osmoprotection,装载液处理);③玻璃化溶液脱水(dehydration with PVS);④投入液氮快速冷冻(rapid cooling);⑤保存后快速化冻(rapid warming);⑥洗涤(dilution,去装载和洗涤玻璃化溶液);⑦恢复培养(plating for re-growth)(Sakai et al.,2008)(见图1-2)。
玻璃化法超低温保存是1937年首次提出的,之后经过长期的探索,于20世纪80年代发展起来。1968年Ralph首次利用玻璃化法超低温保存亚麻(Linum usitatissimum)悬浮细胞,1989年Langis等和Uragami等相继保存了油菜(Brassica campestris)悬浮细胞和芦笋(Asparagus officinalis)体细胞胚,进一步证实了玻璃化冻存植物材料的可行性。
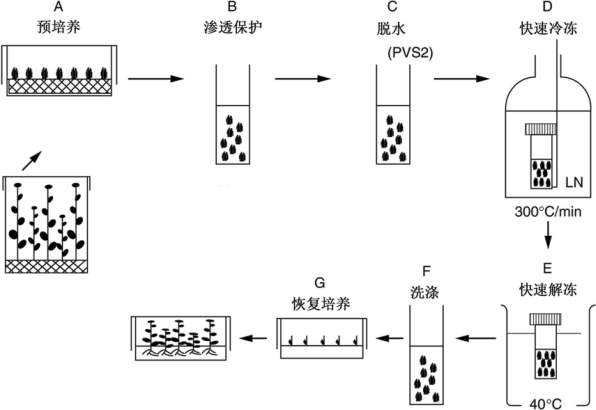
图1-2 植物玻璃化法超低温保存技术流程(Sakai,2004)
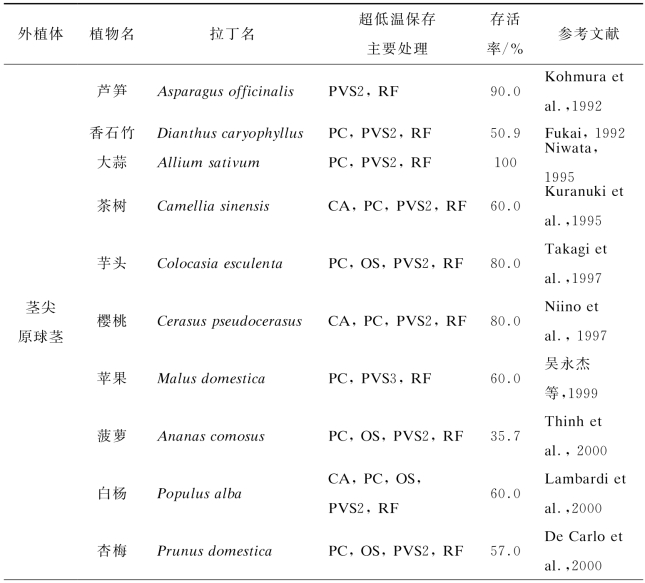
与其他超低温保存方法相比,玻璃化法以其设备简单、操作简便快捷、省时省力、适宜保存种类广泛、保存效果好和重复性强等优点倍受研究人员推崇,是较为理想的植物种质资源保存方法(Langis et al.,1990),并且在复杂的组织和器官的超低温保存方面有较好的应用潜力,是近十年来用于优良种质资源中长期保存的首选方法(见表1-1)。自1968年玻璃化法超低温保存亚麻悬浮细胞以来,国内外已对200多种植物的茎尖分生组织、愈伤组织、悬浮细胞、花粉、种子、芽和幼苗等进行了超低温保存(见表1-2)。
表1-1 常用植物超低温保存技术的优缺点对比一览表(Reed,2001)
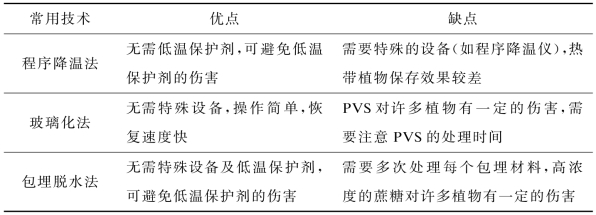
表1-2 部分植物玻璃化法超低温保存方法一览表(https://www.xing528.com)
(续表)

(续表)

(续表)

注:低温预培养:cold acclimation,CA;高渗预培养:preculture,PC;渗透保护:osmoprotection,OS;PVS2脱水处理:PVS2;PVS3脱水处理:PVS3;快速冷冻:rapid freezing,RF;二步法冷冻:two-step freezing,TS;慢速冷冻:slow freezing,SF;乙二醇:ethylene glycol,EG;山梨醇:sorbitol,Sor;牛血清蛋白:bovine serum albumin,BSA;二甲基亚砜:dimethylsulfoxide,Me2SO;丙三醇:glycerol,Gly;蔗糖:sucrose,Suc;葡萄糖:glucose,Glu
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




