酶促反应速度主要受酶浓度、底物浓度、pH 值、温度、抑制剂、激活剂等因素的影响。
1)酶浓度的影响
在反应条件一定的情况下,当底物浓度远远超过酶浓度时,酶的浓度与反应速度呈正比关系,如图2.3 所示。
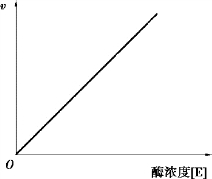
图2.3 反应速度与酶浓度的关系
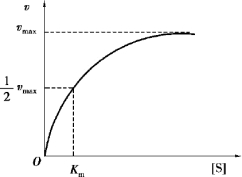
图2.4 底物浓度对酶反应速度的影响
2)底物浓度的影响
在酶的浓度不变的情况下,底物浓度对反应速度的影响作用呈现矩形双曲线,如图2.4 所示。 在底物浓度很低时,反应速度随底物浓度的增加而急剧加快,两者呈正比关系,表现为一级反应。 随着底物浓度的升高,反应速度不再呈正比例加快,增加的幅度不断下降。 如果继续加大底物浓度,反应速度不再增加,表现为0 级反应。 此时,无论底物浓度增加多大,反应速度也不再增加,说明酶已被底物饱和。 所有的酶都有饱和现象,只是达到饱和时所需底物浓度各不相同而已。 为了说明底物浓度与反应速度之间的关系,1913 年,Michaelis 和Menten 提出了一个方程式,称为米氏方程。
![]()
式中,Vmax为最大反应速度;[S]为底物浓度;Km 为米氏常数;v 为在不同底物浓度[S]时的反应速度。
3)pH 值的影响
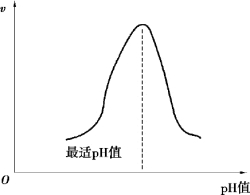
pH 值影响酶的构象,也影响与催化有关的基团的解离状况及底物分子的解离状态。 每种酶只能在一定的pH 值范围内才表现出活性,使酶促反应速度达到最大时的pH 值称为酶的最适pH 值。 一般酶的最适pH 值为6 ~8,少数酶的作用条件偏酸或偏碱,如胃蛋白酶最适pH值为1.5,而肝精氨酸酶最适pH 值为9.7。 最适pH 值不是酶的特征性常数,更不是完全不变的,有时因底物种类、浓度及缓冲溶液成分不同而变化,大部分酶的pH-酶活曲线是钟形曲线,如图2.5 所示。 但也有少数酶只有钟形的一半,甚至是直线。 如木瓜蛋白酶底物的电荷变化对催化没有影响,pH 值在4 ~10 之间是一条直线。
4)温度的影响
酶活性随温度变化的曲线也是钟形曲线,如图2.6 所示。 酶促反应速度有一个最高点,所对应的温度即为最适温度。 温血动物的酶最适温度是35 ~40 ℃,植物酶最适温度为40 ~50 ℃,这是温度升高时化学反应加速(每升温10 ℃反应速度加快1 ~2 倍)与酶失活综合平衡的结果。 一般酶在60 ℃以上变性,少数酶可耐高温,如牛胰核糖核酸酶加热到100 ℃仍不失活。 最适温度也不是固定值,它受反应时间影响,酶可在短时间内耐受较高温度,时间延长则最适温度降低。
 (https://www.xing528.com)
(https://www.xing528.com)
图2.5 pH 值对酶反应速度的影响
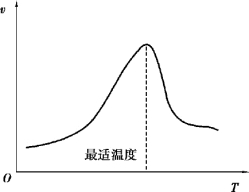
图2.6 温度对酶反应速度的影响
5)激活剂的影响
酶的催化活性在某些物质影响下可以增高或降低。 凡是能使酶活性增高的物质,称为酶的激活剂。 如唾液淀粉酶活力不高时,加入一定量的NaCl,酶的活力会大大增加,因为Cl -是唾液淀粉酶的激活剂。 与激活剂相对应的,凡是能降低或抑制酶活性的物质称为抑制剂。 激活剂和抑制剂的作用都不是绝对的,同一种物质可能对不同的酶作用不同,如氰化物是细胞色素氧化酶的抑制剂,却是木瓜蛋白酶的激活剂。 酶的激活是酶的活性由低到高,不伴有一级结构的改变,酶的激活剂又称酶的激动剂。
酶的激活剂大多是金属离子,其中以正离子较多,有K +、Na +、Mg2+、Mn2+、Ca2+、Zn2+等,如Mg2+是RNA 酶、脱羧酶等的激活剂;常作为激活剂的阴离子有Cl -、Br -、I -等。 还有一些小分子有机化合物也可以作为酶的激活剂,主要有半胱氨酸、还原型谷胱甘肽、维生素C 等,它们能激活某些酶,主要是使含巯基的酶中被氧化的二硫键还原成巯基,恢复酶的活力;或者作为金属整合剂,除去酶中重金属杂质,解除重金属对酶的抑制作用。
6)抑制剂的作用
使酶活力下降但不引起酶蛋白变性的作用称为抑制作用。 能引起抑制作用的物质称为酶的抑制剂。 抑制剂与酶分子上的某些必需基团反应,引起酶活力下降,甚至丧失,但并不使酶变性。 研究抑制作用有助于对酶的作用机制、生物代谢途径、药物作用机制的了解。 抑制作用根据可逆性可分为两类:不可逆抑制与可逆抑制。
(1)不可逆抑制
此类抑制剂通常以共价键与酶结合,不能用透析、超滤等方法除去。 常见的不可逆抑制剂有有机磷化合物、有机砷、汞化合物、氰化物、重金属、烷化剂等。 还有一类称为自杀底物,有些酶的专一性较低,它们的天然底物的某些类似物或衍生物都能和它们发生作用。 这些类似物或衍生物中的一类,在它们的结构中潜在一种化学活性基团,当酶把它们作为一种底物来结合并在酶促催化作用进行到一定阶段以后,潜在的化学基团就能被活化,成为有活性的化学基团并和酶蛋白活性中心发生共价结合,使酶失活。 这种过程称为酶的“自杀”或酶的自杀失活作用,这类底物则称为“自杀底物”。
(2)可逆抑制
抑制剂与酶以非共价键可逆结合而引起酶活力的降低或丧失,用物理方法除去抑制剂后可使酶活力恢复的作用称为可逆抑制作用,这种抑制剂称为可逆抑制剂。 根据抑制剂与底物的关系,可逆抑制可分为以下3 种。
①竞争性抑制。 抑制剂结构与底物类似,与酶形成可逆的复合物但不能分解成产物。 抑制剂与底物竞争酶的活性中心,从而阻止底物与酶的结合。 这种抑制可通过提高底物浓度来减弱。 竞争性抑制最常见,如磺胺类药物中对氨基苯磺胺结构上与对氨基苯甲酸相似,是细菌二氢叶酸合成酶的竞争性抑制剂,它可抑制细菌二氢叶酸合成酶,从而抑制细菌生长繁殖。
②非竞争性抑制。 酶可以同时与底物和抑制剂结合,底物和抑制剂没有竞争。 但形成的中间物不能分解成产物,因此酶活降低。 非竞争性抑制剂与酶活性中心以外的基团结合,大部分与巯基结合,破坏酶的构象,如一些含金属离子(铜、汞、银等)的化合物。 EDTA(乙二胺四乙酸)络合金属引起的抑制也是非竞争抑制,如对需要镁离子的己糖激酶的抑制。
③反竞争性抑制。 当反应体系中加入抑制剂时,增加了酶和底物的亲和力,抑制剂不与游离酶结合,而与酶底物复合体结合构成三联复合体,三联复合体不能再分解生成产物。 L-苯丙氨酸等一些氨基酸对碱性磷酸酶的作用是反竞争性抑制。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




