为了考察铁还原条件下多氯联苯脱氯过程中沉积物微环境中微生物群落的变化。本章中采用了qPCR 方法定量了脱氯菌Dehalococcoides、o-17/DF-1、两组硫酸盐还原菌Desulfovibrionales 和Desulfuromonales,其中Desulfuromonales涵盖了铁还原菌目Geobacteraceae,以及总Bacteria 的16S rRNA 基因。考虑到添加了FeOOH 的哈德逊河沉积物微环境的微生物活性较低,实验中仅选取了0 周、9 周、21 周、36 周和51 周的样品进行qPCR 测定。图5.11 为Dehalococcoides 16S rRNA 基因随时间的变化。在哈德逊河的H-1-Fe 组中,Dehalococcoides 并没有随反应时间而增加,Dehalococcoides 16S rRNA 基因始终低于1.5×105copies/ml,而这个浓度在第3章的产甲烷条件下和第4章的硫酸盐还原条件下都是多氯联苯脱氯反应启动时所需要的最低浓度。因而,铁还原条件下很可能是由于缺少足够的活性Dehalococcoides 脱氯菌从而导致多氯联苯脱氯被完全抑制。而在铁还原条件下的格拉斯河沉积物微环境中,无论是添加了PCB Mixture 1 还是PCB Mixture 2,Dehalococcoides 16S rRNA 基因水平随时间都有明显的上升趋势。G-1-Fe 组中,Dehalococcoides 16S rRNA 基因从2.4×106±1.2×105上升到9.2×107±3.1×106copies/ml;在G-2-Fe 组中则从1.8×106±2.5×105上升到1.1×108±3.1×106copies/ml。与未添加FeOOH的沉积物微环境组G-1 和G-2 相比,添加了FeOOH 的G-1-Fe 和G-2-Fe 组中的Dehalococcoides 16S rRNA 基因要高出5~10 倍。虽然Dehalococcoides 不能直接利用Fe(III)作为其终端电子受体获取能量[76,154],但是铁还原菌可能作为其重要的共代谢菌出现。研究发现一些铁还原菌,如Geobacter sulfurreducen 可以和H2氧化微生物共同作用促进产H2,而H2被认为是Dehalococcoides的首选电子供体[76,154,155]。此外,铁还原菌也可以通过发酵作用产生H2[92]。这两种产H2机制都可以解释在格拉斯河添加FeOOH 的沉积物微环境组中Dehalococcoides 水平比其未添加FeOOH 的微环境组要高。然而,G-1-Fe 和G-2-Fe 组中高的Dehalococcoides 16S rRNA 基因水平并没有使得铁还原条件下总的多氯联苯脱氯水平得到增强,脱氯程度低于G-1 和G-2 组。多氯联苯分析显示,脱氯能力的减弱主要是由于UF Para 相关的脱氯路径被抑制了,这说明虽然Dehalococcoides 总量在增加,但其群落结构或者脱氯基因的表达发生了一定的变化,从而导致某些脱氯路径不再进行。
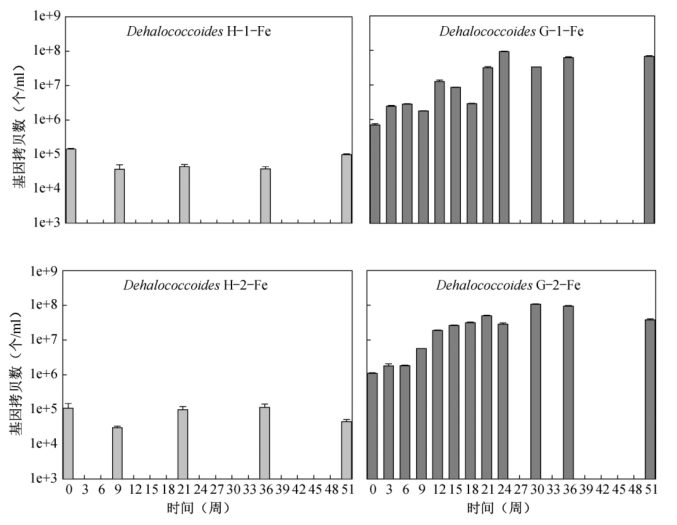
图5.11 H-1-Fe、G-1-Fe、H-2-Fe、G-2-Fe 组中Dehalococcoides 16S rRNA 基因随时间的变化
与第3章和第4章中的结果类似,Dehalococcoides 在铁还原条件下的格拉斯河沉积物微环境中也被选择性富集(图5.12)。Dehalococcoides 16S rRNA 基因的相对百分比在G-1-Fe 和G-2-Fe 组中,分别从最低0.2%提高到2.5%和从0.2%提高到2.6%。Dehalococcoides 的富集也从一个侧面证明脱氯活动在持续进行中。(https://www.xing528.com)
在铁还原条件下的格拉斯河沉积物微环境中,Desulfovibrionales 和Desulfuromonales 的水平也有所提高,说明它们也具有一定的铁还原活性和/或互营性。o-17/DF-1 则没有发现有明显升高,说明其在G-1-Fe 和G-2-Fe 组中都较为缺乏。
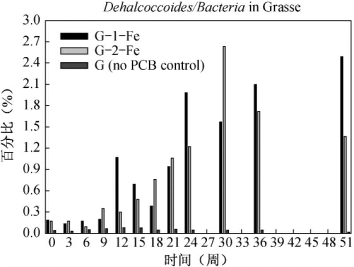
图5-12 G-1-Fe、G-2-Fe、G 组中Dehalococcoides 16S rRNA 占总Bacteria 16S rRNA 基因的百分比值随时间的变化
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




