多氯联苯厌氧脱氯的速率、脱氯程度和脱氯历程等受到多种物理和地球化学因素的影响,其中研究较多的有温度、pH 和氧化还原水平、碳源、电子供体、电子受体以及抑制物等。
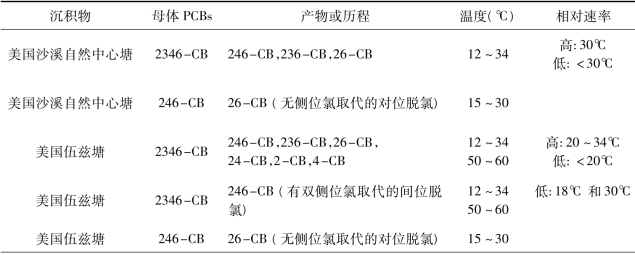
温度不仅决定了多氯联苯在各相之间的迁移分配,更控制了脱氯反应动力学[60]。Tiedje 和Wu 等[50,57,79-81]研究总结了4℃~66℃之间的18 个不同反应温度下的多氯联苯降解规律(见表1.6)。对比美国沙溪自然中心塘和伍兹塘沉积物中PCB 62(2346-CB)的脱氯降解发现,伍兹塘中的脱氯速率和脱氯程度均高于沙溪自然中心塘。对于间位脱氯,在伍兹塘中,脱氯在8℃~34℃和50℃~60℃两个温度范围内均可进行;而在沙溪自然中心塘中,脱氯仅在12℃~34℃较窄的温度范围内发生,最优温度为30℃。对于对位脱氯,在伍兹塘中,该脱氯反应发生在18℃~34℃范围内,最优温度为20℃;而在沙溪自然中心塘中,对位脱氯发生在18℃~30℃范围内,最优温度在30℃。邻位脱氯仅在伍兹塘里可以发生,反应温度在8℃~30℃。反应路径分析显示,温度不仅影响脱氯的速率也改变了脱氯的偏好(Dechlorination preference):在除了18℃和34℃之外的反应温度下,间位脱氯(2346-CB 到246-CB)较对位脱氯(2346-CB 到236-CB)有显著优势;无侧位氯取代的对位脱氯路径(246-CB 到26-CB)只在15℃~30℃范围内出现;而邻位脱氯路径(246-CB 到24-CB)仅在伍兹塘15℃~30℃的范围内出现,且以15℃的反应最为明显。随后,在对伍兹塘中残留的多氯联苯混合物Aroclor 1260 降解研究中发现,温度同时改变反应速率和反应历程。8℃~30℃时以历程N(间位脱氯)为主导;12℃~34℃范围内以历程P(对位脱氯)为主,且温度越高反应速率越快;18℃~30℃范围内也有历程LP(无侧位氯取代的对位脱氯)存在;在50℃~60℃的高温条件下脱氯沿历程T(2345-上的间位氯)进行。Tiedje 等[79]发现在哈德逊河中,温度低于12℃或高于37℃均无多氯联苯脱氯发生。也就说,冬季低温下脱氯降解停止。同时考虑共代谢底物和温度的影响,人们一般认为,温度可能是通过改变不同脱氯菌种的生长速率或脱氯酶的活性来影响脱氯行为的。
表1.6 温度对脱氯的影响*
续表1.6
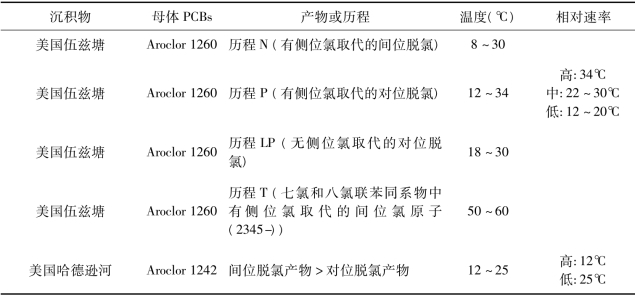
*:此表修订自文献[50]、[57]、[79-81]
pH 也是可以影响多氯联苯微生物脱氯的重要因素,尽管在pH 5~pH 8的范围内多氯联苯脱氯都能够进行,但最大速率都出现在典型沉积物pH 7~pH 7.5 范围之间,除了速率,脱氯位置也和pH 有一定关系,对位脱氯发生在pH 6~pH 8 之间;邻位脱氯在pH 6~pH 7.5 范围内进行;仅有间位脱氯受pH影响较少[82]。pH 影响脱氯的原因可能有以下三个:(1)pH 改变多氯联苯在沉积物介质上的吸附行为,从而影响多氯联苯的生物利用性[83];(2)pH 改变微生物菌群结构;(3)pH 直接影响反应自由能和氧化还原电位(ORP)。通常,低氧化还原电位有利于多氯联苯脱氯,因而,我们所观察到的大多数脱氯都伴随着产甲烷作用(Methanogenesis)[63,84-87]。天然沉积物通常是较好的缓冲体系,在脱氯过程中pH 变化一般不大,保证了自然界多氯联苯脱氯可以稳定进行。
多氯联苯微生物脱氯中,除了多氯联苯自身作为终端电子受体,还需要其他物质充当碳源和电子供体。在沉积物体系中存在多种多样的天然有机物可以为微生物的生长提供碳和电子。然而,多氯联苯脱氯菌生长的必要碳源是什么尚不明晰,只能通过已有的研究结果推断碳源的选择和脱氯菌的种、株有关。Wu 等发现一些脱氯菌必须用乙酸作为碳源,而另一些脱氯菌需要甲酸或者H2-CO2(体积比80∶20)作为碳源和电子供体[34,69]。也就是说,有机和无机碳源都对脱氯微生物的生长起重要作用。通过对添加有机碳源甲酸、乙酸、丙酮酸、乳酸、葡萄糖、甲醇、丙酮和无机碳源二氧化碳、碳酸氢钠等的研究发现:一方面,外加碳源可以为脱氯微生物的生长提供足够的碳元素和能量,促进多氯联苯脱氯的进行;另一方面,外加碳源同时也导致其他竞争微生物快速生长,从而抑制了脱氯菌作用[19,35,41,60,67,87-90]。结果总结于表1.7。此外,外加碳源并不是越多越好,低浓度的碳酸氢钠(100 mg/L)有助于适宜脱氯的微生物群落的形成,而高浓度碳酸氢钠(500 mg/L)可能阻碍了多氯联苯脱氯菌的乙酸代谢,转而促进热力学上更有益的产乙酸菌生长[87]。由于各研究实验条件不同,如添加碳源有的是反应初始一次性添加,有的是周期性添加,添加量也有较大差异。因而,碳源的优劣以及适宜的添加量尚未有明确结论。(https://www.xing528.com)
表1.7 多氯联苯微生物脱氯中有机碳源的作用

天然沉积物环境中存在的阴离子如![]() 和
和![]() 也是良好的电子受体,它们分别是反硝化菌和硫酸盐还原菌的首选,和多氯联苯存在竞争关系。研究发现
也是良好的电子受体,它们分别是反硝化菌和硫酸盐还原菌的首选,和多氯联苯存在竞争关系。研究发现![]() 的存在抑制了多氯联苯脱氯[63]。与之相似,3~30
的存在抑制了多氯联苯脱氯[63]。与之相似,3~30![]() 也有抑制脱氯的效果,从脱氯位置上看间位脱氯被抑制得最为明显,有侧位氯取代的对位脱氯和双侧氯取代的间位脱氯活性被部分保留[19,31,34,63,84,85,91]。May 等[84]曾指出,脱氯只有在
也有抑制脱氯的效果,从脱氯位置上看间位脱氯被抑制得最为明显,有侧位氯取代的对位脱氯和双侧氯取代的间位脱氯活性被部分保留[19,31,34,63,84,85,91]。May 等[84]曾指出,脱氯只有在![]() 被完全消耗后才开始进行,但Rysavy 等[37]在实验中发现了
被完全消耗后才开始进行,但Rysavy 等[37]在实验中发现了![]() 存在下的多氯联苯脱氯现象,这可能是由于某些硫酸盐还原菌能够利用多氯联苯作为其替代电子受体完成还原反应。三价铁也是多氯联苯的竞争电子受体。Morris 等[85]研究发现,50 mmol/L 的羟基氧化铁(FeOOH)可抑制多氯联苯脱氯,但其抑制的程度较10 mmol/L 的
存在下的多氯联苯脱氯现象,这可能是由于某些硫酸盐还原菌能够利用多氯联苯作为其替代电子受体完成还原反应。三价铁也是多氯联苯的竞争电子受体。Morris 等[85]研究发现,50 mmol/L 的羟基氧化铁(FeOOH)可抑制多氯联苯脱氯,但其抑制的程度较10 mmol/L 的![]() 和10 mmol/L 的溴乙基磺酸(BESA,产甲烷菌抑制剂)要低。也有研究结果显示,三价铁并没有抑制四氯乙烯的脱氯,脱氯菌与三价铁还原菌同步富集[92]。
和10 mmol/L 的溴乙基磺酸(BESA,产甲烷菌抑制剂)要低。也有研究结果显示,三价铁并没有抑制四氯乙烯的脱氯,脱氯菌与三价铁还原菌同步富集[92]。
氢气(H2)是沉积物环境中重要的电子供体,部分微生物自身有产氢功能。H2对多氯联苯脱氯的影响较为复杂,常需要和碳源、电子受体等因素综合考虑。通常,体积分数小于1%的H2不会对脱氯产生显著影响,中等浓度的H2促进脱氯,而高于10%的H2可以抑制某些脱氯反应的进行并改变脱氯路径和历程[60,93]。实践中常通过添加零价铁(Fe(0))的方法来增加体系中的H2[37,94],反应方程式如式1.2所示。假设体系的pH 等于7,![]() +的浓度为10-3mol/L,经过计算该反应的ORP 为0.17 V。由此可见,天然沉积物环境中铁的锈蚀为多氯联苯脱氯充当了电子供体,提供微生物生长需要的能量。此外,锈蚀反应生成的Fe2+能够沉淀体系中溶解的脱氯抑制物负二价硫,从而强化多氯联苯脱氯[37]。
+的浓度为10-3mol/L,经过计算该反应的ORP 为0.17 V。由此可见,天然沉积物环境中铁的锈蚀为多氯联苯脱氯充当了电子供体,提供微生物生长需要的能量。此外,锈蚀反应生成的Fe2+能够沉淀体系中溶解的脱氯抑制物负二价硫,从而强化多氯联苯脱氯[37]。
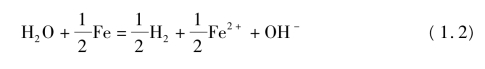
多氯联苯脱氯的抑制剂除了提到的负二价硫,还有抗生素类、钼酸盐以及溴乙基磺酸等。不同抑制物的作用机理各不相同。溶解态的负二价硫(H2S,HS-和S2-)是杀菌剂,而非溶解态的负二价硫对细菌无害,因此常用重金属沉淀的方法来去除溶解态负二价硫。Zwiernik 等[95]曾发现添加FeSO4可促进Aroclor 1242 的深度脱氯,该结果和其他添加![]() 导致脱氯抑制的现象相反,只能用
导致脱氯抑制的现象相反,只能用![]() 的还原产物以FeS 沉淀的形式存在来解释。由于S2-对多氯联苯脱氯的抑制,微生物培养液中的还原剂Na2S 现已经被L-半胱氨酸所替代[85,88]。青霉素G-加D 环丝氨酸可以直接抑制细菌生长并间接抑制古细菌中产甲烷菌生长,从而导致多氯联苯脱氯的停滞[96]。其他抗生素如氨比西林、氯霉素、新霉素、链霉素等也具有脱氯抑制性[34]。钼酸盐阻碍硫酸盐还原菌和其他一些细菌的生长,对多氯联苯脱氯也存在一定的抑制作用[34]。溴乙基磺酸抑制产甲烷菌作用,在产甲烷活性降低的同时,研究发现多氯联苯脱氯的滞后期显著增长,脱氯程度大大降低,从而推测部分产甲烷菌也可能具备脱氯功能[85,96]。
的还原产物以FeS 沉淀的形式存在来解释。由于S2-对多氯联苯脱氯的抑制,微生物培养液中的还原剂Na2S 现已经被L-半胱氨酸所替代[85,88]。青霉素G-加D 环丝氨酸可以直接抑制细菌生长并间接抑制古细菌中产甲烷菌生长,从而导致多氯联苯脱氯的停滞[96]。其他抗生素如氨比西林、氯霉素、新霉素、链霉素等也具有脱氯抑制性[34]。钼酸盐阻碍硫酸盐还原菌和其他一些细菌的生长,对多氯联苯脱氯也存在一定的抑制作用[34]。溴乙基磺酸抑制产甲烷菌作用,在产甲烷活性降低的同时,研究发现多氯联苯脱氯的滞后期显著增长,脱氯程度大大降低,从而推测部分产甲烷菌也可能具备脱氯功能[85,96]。
在过去的研究中,人们使用了多种多氯联苯单体,如PCB 62(2346-CB)、PCB 65(2356-CB)、PCB 30(246-CB)、PCB 116(23456-CB)和Aroclor 系列混合物,如Aroclor 1242、1248、1254 和1260。这些单体和混合物又以不同的浓度和组成出现在脱氯实验中。尽管各个研究的结果各异,无法形成一般性结论,多氯联苯的浓度和组成对脱氯的程度、速率和脱氯类型的影响是普遍而显著的。此外,包括多氯联苯单体本身和其他的卤代化合物在内的共代谢底物的存在,被证明可以促进多氯联苯脱氯反应[40,45,46,50,58,89,97]。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




