1884 年,瑞士中学教师巴尔末发现氢原子光谱在可见光区域的4 条不同波长的谱线,这些谱线可以用一个简单的公式表示,

这个公式称为巴尔末公式,B =364.44 nm,n 为正整数.1890 年,瑞典物理学家里德伯为了解释原子光谱的规律性,对原子结构进行了广泛的研究,发现整个氢原子光谱的谱系可以表示为

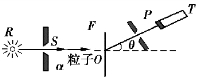
图14.1 α 粒子散射实验
 (https://www.xing528.com)
(https://www.xing528.com)
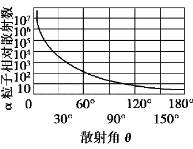
图14.2 α 粒子散射数量随角度的变化
1897 年J.J.汤姆孙发现电子之后,提出了原子的“葡萄干蛋糕”模型.该模型认为原子中正电荷以均匀的密度分布在整个原子小球中,电子则均匀地浸浮在这些正电荷中,这一理论可以解释一些实验事实.为了验证这一理论模型,1909 年英国物理学家卢瑟福进行了α 粒子的散射实验.实验装置如图14.1 所示,图中R 是放射源镭,从中放出α 粒子,粒子的质量为电子质量的7 400倍,带电量为+2e.粒子通过小孔S 后照射在金箔F 上,被F 散射后向各个方向运动.探测器P 可以在绕O 点的平面内转动,从而可以测定在不同散射角θ 上的α 粒子数.
实验结果显示,绝大多数α 粒子穿过金箔后沿着原来方向或沿着散射角很小(θ 只有2~3°)的方向运动.但是有极少数的α 粒子的散射角θ 大于90°,甚至有的α 粒子的散射角接近180°,如图14.2 所示.这一实验结果与汤姆孙的原子模型不相符.为了解释实验结果,卢瑟福放弃了汤姆孙的模型,而提出了自己的理论.他认为只有原子的质量集中于中心,且带正电荷,才能使极少数α 粒子发生大角度散射.卢瑟福于1911 年提出了一种“核式结构模型”,即原子的行星模型.该模型的主要观点是,原子的中心有一带正电的原子核,数值等于原子序数与基本电量之积,它几乎集中了原子的全部质量,电子围绕这个核旋转,核的体积与整个原子相比是很小的.
由于原子核很小,绝大多数α 粒子穿过原子时,因受原子核的作用很小,故它们的散射角θ 很小.只有少数α 粒子进入距原子核很近的地方,这些α 粒子受核的作用较大,所以它们的散射角较大.极少数α 粒子正对原子核运动,它们的散射角接近180°.散射角越大,α 粒子数越少.
按照原子核式模型,氢原子由原子核和一个核外电子组成.核外电子绕原子核作圆轨道运动.电子的电荷为-e,原子核的电荷为+e,原子核的质量约为电子质量的1 837 倍.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




