1.吸收机理
对于吸收机理的解释以双膜理论模型应用较广。双膜理论模型如图5-6所示。图中,p表示组分A在气相主体中的分压,pi表示在相界面上的分压,c及ci则分别表示组分A在液相主体及界面上的浓度。

图5-6 双膜理论模型
双膜理论模型的基本要点如下。
(1)当气液两相接触时,两相之间有一个相界面,在相界面两侧分别存在着呈层流流动的气膜和液膜。溶质必须以分子扩散方式从气流主体连续通过这两个膜层而进入液相主体。
(2)在相界面上,气液两相的浓度总是互相平衡,即界面上不存在吸收阻力。
(3)在膜层以外的气相和液相主体内,由于流体的充分湍动,溶质的浓度基本上是均匀的,即认为主体内没有浓度梯度存在,也就是说,浓度梯度全部集中在两层膜内。
双膜理论根据上述假定,把吸收过程简化为通过气液两层层流膜的分子扩散,通过此两层膜的分子扩散阻力就是吸收过程的总阻力。
2.吸收速率方程
吸收质在单位时间内通过单位面积界面而被吸收剂吸收的量称为吸收速率。它可以反映吸收的快慢程度。根据双膜理论,在稳态吸收操作中,从气相主体传递到界面吸收质的通量等于从界面传递到液相主体吸收质的通量,在界面上无吸收质积累和亏损。
表述吸收速率及其影响因素的数学表达式,即为吸收传质速率方程,其一般表达式为:吸收速率=吸收推动力×吸收系数,或者吸收速率:吸收推动力/吸收阻力。吸收系数和吸收阻力互为倒数。吸收推动力表示方法有多种,因而吸收速率方程也有多种表示方法。
(1)气相分传质速率方程:设y和yi分别为气相主体和相界面上吸收质的摩尔分数,则气相分传质速率方程式可写为
![]()
式中,NA——吸收速率,kmol/(m2·s);
y、yi——被吸收组分在气相主体和相界面上的摩尔分数;
ky——以(y-yi)为气相传质推动力的气相分吸收系数,kmol/(m2·s)。
如果以(p-pi)为气相传质推动力,则式(5-6)可写为
![]()
式中,NA——吸收速率,kmol/(m2·s);
p、pi——被吸收组分在气相主体和相界面上的分压,Pa;
kG——以(p-pi)为气相传质推动力的气相分吸收系数,kmol/(m2·s·Pa)。
(2)液相分传质速率方程:以(xi-x)或(ci-c)为液相传质推动力,则液相分传质速率方程式为

式中,x、xi——被吸收组分在液相主体和相界面上的摩尔分数;
c、ci——被吸收组分在液相主体和相界面上的物质的量浓度,kmol/m3;
kx——以(xi-x)为液相传质推动力的液相分吸收系数,kmol/(m2·s);
kL——以(ci-c)为液相传质推动力的液相分吸收系数,kmol/[m2·s·(kmol·m)],简化为m/s。
(3)总传质速率方程:以一个相的虚拟浓度与另一相中该组分平衡浓度的浓度差为总传质过程的推动力,则分别得到稳定吸收过程的气相和液相总传质速率方程式。
气相总传质速率方程式

式中,Ky——以(y-y*)为推动力的气相总吸收系数,kmol/(m2·s);
KG——以(p-p*)为推动力的气相总吸收系数,kmol/(m2·s·Pa);
y*——与液相中吸收质浓度成平衡的气相虚拟浓度;
p*——与液相主体中吸收质浓度成平衡的气相虚拟分压,Pa。
液相总传质速率方程式
 (https://www.xing528.com)
(https://www.xing528.com)
式中,Kx——以(x*-x)为推动力的液相总吸收系数,kmol/(m2·s);
KL——以(c*-c)为推动力的液相总吸收系数,m/s;
x*——与气相中组分浓度相平衡的液相虚拟浓度;
c*——与气相中组分分压成相平衡的液相中被吸收组分的物质的量浓度,kmol/m3。
3.气液平衡
当混合气体与液相吸收剂接触时,部分吸收质向吸收剂进行质量传递(即吸收过程),同时也发生液相中吸收质组分向气相逸出的质量传递过程(即解吸过程)。在一定的温度和压力下,吸收过程的传质速率等于解吸过程的传质速率时,气液两相就达到了动态平衡,简称相平衡或平衡。平衡时气相中的组分分压称为平衡分压,液相吸收剂(溶剂)所溶解组分的浓度称为平衡溶解度,简称溶解度。
4.吸收系数
(1)吸收系数之间的关系:由于吸收推动力表示方法不同,吸收速率方程式呈现了多种不同的形式,对应地出现了多种形式的吸收系数,应用时,应注意吸收系数和传质推动力相对应。
当气相浓度以分压表示,液相浓度以摩尔分数表示,且气液平衡关系服从亨利定律时,吸收速率方程式与气液界面平衡关系式yi=m×xi进行联立,即可得到气相总吸收系数与气、液相传质分系数的关系式,即
![]()
式中,m——相平衡常数的平均值,可按下式计算
![]()
式中,m*——与液相中吸收质浓度也成平衡的相平衡常数值。
同理,也可得到液相总吸收系数与气、液相传质分系数的关系式,即

此时,相平衡常数的平衡值,可由下式求得

式中,m0——虚拟浓度x*时的相平衡常数值。
(2)气膜控制和液膜控制:根据“双膜”理论,气体吸收传质过程的总阻力等于气相传质阻力和液相传质阻力之和。传质阻力为吸收系数的倒数,所以式(5-14)中1/ky为组分在气相主体中的传质阻力,m/kx为组分在液相主体流中的传质阻力,组分从气相传质到液相的总阻力即为两个阻力之和1/ky。同样对于式(5-16),1/mky,为组分在气相主体中的传质阻力,而1/kx是组分在液相中的传质阻力,传质的总阻力为1/Kx。在总阻力中每一相的阻力所占的分数,不仅取决于kx和ky值,而且还取决于相平衡常数m。
对于易溶气体组分,溶质在吸收剂中的溶解度很大,m值很小,组分在液相中的传质可以忽略,这时总吸收系数可近似地认为等于气相分吸收系数,即Ky≈ky,这种情况下的传质速率为气膜传质过程所控制,如碱或氨溶液吸收SO2的过程。
对于难溶气体组分,溶质在吸收剂中的溶解度很小,m值很大,可以忽略组分在气体中的传质阻力。这时总吸收系数可近似地认为等于液相中的传质组分系数,即Kxkx。这种情况下的传质速率为液膜传质过程所控制,如碱液吸收CO2、水吸收O2等过程。
对于中等溶解度的气体组分,即m值适中时,组分在气、液两相中所表现出的传质阻力都不可忽略,这时组分的传质速率受气、液膜传质过程所控制,如水吸收SO2、丙酮等过程。
(3)吸收系数计算:传质过程的影响因素十分复杂,对于不同的物质、不同的设备及填料类型和尺寸,以及不同的流动状况与操作条件,吸收系数各不相同。设计吸收设备时,获取吸收系数的途径有:实验测定,选用适当的经验公式进行计算,选用适当的准数关联式进行计算。
实验测定是获得吸收系数的根本途径。但限于种种原因,实际上不可能对每一具体设计条件下的吸收系数都进行直接的实验测定。不少研究者针对某些典型的或有重要实际意义的系统和条件,取得比较充分的实测数据,在此基础上提出了特定物系在特定条件下的吸收系数经验公式。这种经验公式只在用于规定条件范围之内时才能得到可靠的计算结果。
5.界面浓度
显而易见,要通过式(5-6)~式(5-9)计算吸收速率,必须要知道气液两相界面上的浓度。气液界面上浓度难以用取样分析法测定,常用作图法和解析法计算。
(1)作图法:对于稳定吸收过程,在气液两相界面上无物质积累或消耗,组分A通过气膜的吸收速率必与通过液膜的吸收速率相等,则

上式中x、y分别是吸收设备内某一截面上气相主体中组分A浓度和液相主体中浓度,是易测定的;若kx、ky已知,则上式在x、y坐标系中是一条通过点(xi,yi)而斜率为-kx/ky的直线。由于气液界面上气液处于平衡状态,所以界面上液相浓度和气相浓度的坐标点(xi,yi)一定在气液平衡线上,即该直线与气液平衡线的交点坐标即为界面浓度,如图5-7所示。
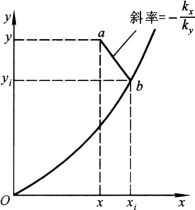
图5-7 界面浓度的确定
(2)解析法:稀溶液服从亨利定律,可用解析法计算界面浓度。因界面上xi和yi为平衡关系,所以
![]()
上式和式(5-19)联立求解,即可解得界面浓度xi和yi,即

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




