1.燃料中硫的氧化机理
燃烧中硫氧化物的形成,可以分成燃料中可燃性硫(元素硫、硫化物和有机硫)在燃烧过程中与氧反应氧化到SO2,SO2氧化到SO3和SO3生成硫酸三个步骤。
燃料燃烧过程中,有机硫和无机硫首先分解出含硫化合物H2S、CS2、羰基硫(COS)、元素硫和含硫有机物。
H2S的氧化包括直接氧化、生成OH和生成水三个阶段,第二个阶段决定SO2的浓度;CS2、COS、元素硫通过链反应被氧化;含硫有机物通过分解、取代和氧化转化为SO2。
主要的硫氧化产物是SO2和SO3,但SO3的浓度相当低,即使在贫燃料状态下,生成的SO3也只占SO2生成量的百分之几。在富燃料状态下,除SO2外,还有一些其他S的氧化物,如SO及其二聚物(SO)2,还有少量一氧化二硫S2O,这些产物化学反应能力强,所以,仅在各种氧化反应中以中间体形式出现。故一般主要生成SO2,计算时则忽略SO3。
2.SO2和SO3之间的转化
低浓度的SO3,通过下列反应(2-6)产生,在高温下又通过反应式(2-7)(2-8)(2-9)被消耗。

在炽热反应区,原子态O浓度很高,反应(2-6)和反应(2-7)起支配作用。SO3主要在贫燃条件下产生,经估算,SO3为SO2的0.1%~0.5%。受热面和金属氧化物的催化作用可以大大提高SO3的浓度。在富燃料状态下,SO2向SO3的转化基本上被抑制了。(https://www.xing528.com)
燃烧后烟气中的水蒸气可能与SO3结合生成H2SO4,转化率为
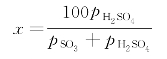
从图2-3、图2-4可以看出转化率与温度密切相关,温度越低,转化率越大。当温度低110℃时,SO3几乎全部与水蒸气结合成H2SO4蒸气。H2SO4蒸气的存在使烟气的露点(也称酸露点)显著提高。H2SO4浓度越高,酸露点越高,越容易引起管道和空气净化等设施的腐蚀。
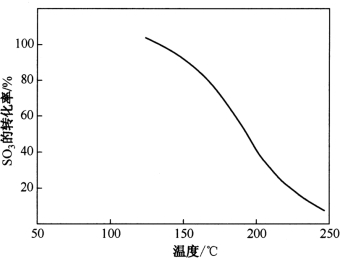
图2-3 SO3向H2SO4的转化率与温度的关系
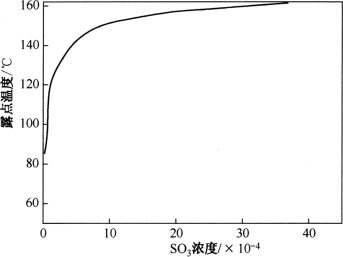
图2-4 酸露点与SO3浓度的关系
据估计,全球从燃烧系统排入大气的含硫化合物中硫的总量约9.3×107t/a,其中70%从燃用化石燃料的发电厂排出。进入大气中SOx转化成MeSO4、硫酸烟雾等。硫的氧化产物不仅造成大气污染,而且由于它们的腐蚀性,会引起燃气轮机和其他工业动力装置中一些严重的物理问题,也可能影响氮氧化物的形成,必须加以控制。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




