一、实验目的
(1)了解质粒DNA分离、纯化和鉴定的原理。
(2)掌握用碱裂解法小量制备质粒DNA的方法。
二、实验原理
质粒是独立存在于染色体外的双链环状DNA分子,可以从细菌中以超螺旋的形式被分离纯化。它独立于宿主染色体外进行复制和遗传,并且赋予宿主细胞一些表型。通常用作基因工程的质粒载体含有遗传选择标记,可以在相应的选择条件下赋予宿主生长优势。
质粒提取的方法通常有碱裂解法、煮沸法等多种。碱裂解同时结合去垢剂SDS可从细菌中分离质粒DNA。当细菌悬液与高pH的强阴离子去垢剂混合后,细胞壁被破坏,染色体DNA和蛋白质变性,质粒DNA被释放到上清溶液中。尽管碱溶液完全打断了碱基配对,但由于环形质粒DNA在拓扑结构上是相互缠绕在一起的,因此质粒的DNA双链不会彼此分开。只要处理不太剧烈,当pH恢复中性后DNA的两条链会立即置新配对。
在裂解过程中,细菌蛋白质、破碎的细胞壁以及变性的染色体DNA形成一些网状的大复合物,表面被十二烷基硫酸包裹。当钠离子被钾离子取代时,这些复合物将被有效地从溶液中沉淀出来。当变性物通过离心被去除后,可从上清液中得质粒DNA。
三、实验器材
1.菌株和质粒
大肠杆菌DH5α,携带有p UC19质粒。
2.缓冲液
(1)溶液Ⅰ:50 mmol/L葡萄糖,25 mmol/L Tris-HCl(pH 8.0),10 mmol/L EDTA(pH 8.0)。
溶液Ⅰ一次可配制约100 mL,在121℃高压蒸汽灭菌15 min,保存于4℃。
(2)溶液Ⅱ:0.2 mol/L氢氧化钠(从10 mol/L贮存液中现用现稀释),1%SDS(从10%SDS贮存液中现用现稀释)。
(3)溶液Ⅲ:5 mol/L乙酸钾60 mL,冰乙酸11.5 mL,水28.5 mL。所配成的溶液中钾的浓度为3 mol/L,乙酸根的浓度为5 mol/L。
3.试剂
实验所需试剂如下:无水乙醇、冰预冷的70%乙醇、酚/氯仿、TE(pH 8.0)、TE(pH 8.0,含20μg/mL RNase A)、LB培养基、氨苄青霉素。
4.实验仪器和其他用具
实验所需仪器和其他用具包括摇床、振荡混合器、离心机、微量取液器、枪头、eppendorf管等。
四、实验步骤
1.质粒DNA的小量快速提取
(1)挑取大肠杆菌DH5α单克隆,接种到含有100μg/mL氨苄青霉素的2 mL LB培养液中,37℃、250 r/min培养过夜。
(2)用1.5 mL的微量离心管收集1.0 mL菌液,以最高速度离心30 s,剩余的菌液保存于4℃。
(3)尽量去除上清液。注意:尽可能去除残存的液体,否则残存物质可能影响限制性内切酶对质粒DNA的切割。
(4)加入100μL冰预冷的溶液Ⅰ,在振荡器上剧烈振荡,使细菌完全悬浮。
(5)加200μL新鲜配制的溶液Ⅱ,盖紧盖子,快速颠倒5次,以混匀溶液,确保整个管子表面都与溶液Ⅱ接触。切勿振荡,否则易造成质粒DNA断裂。
(6)加150μL冰预冷的溶液Ⅲ。盖紧盖子,颠倒数次以保证溶液Ⅲ与黏稠的裂解物混合均匀,置冰上3~5 min。切勿振荡,否则易造成质粒DNA断裂。
(7)在4℃的条件下,以最高速度离心5 min,将上清液转移到新的离心管中。
(8)加等体积的酚/氯仿,盖紧盖子,振荡30 s。在4℃条件下以最高速度离心2 min,将上清液转移到新的离心管中。
(9)加等体积的氯仿,盖紧盖子,振荡30 s。在4℃条件下以最高速度离心2 min,将上清液转移到新的离心管中。(https://www.xing528.com)
(10)加2倍体积的无水乙醇,振荡混匀后置室温2 h。
(11)在4℃的条件下,以最高速度离心5 min。
(12)小心吸除上清液。将离心管倒置在吸水纸上,吸干流出的液体。尽量吸干管壁的液滴。注意:尽可能去除残存的液体,否则残存物质可能影响限制性内切酶对质粒DNA的切割。
(13)加1 m 17%的乙醇。颠倒管子数次。在4℃条件下以最高速度离心2 min。
(14)按步骤(12)的方法,吸除上清液。注意要十分小心,因此时沉淀与管底贴附不紧。
(15)将离心管敞开盖子置室温5~10 min,直至管中的液体完全蒸发。注意:质粒DNA不宜过于干燥,不然将难以溶解,并可能变性。
(16)用50μL含20μg/mL RNase A的TE(pH 8.0,无DNase)溶解DNA。振荡若干秒钟,保存于-20℃。
2.质粒DNA的纯化(PEG法)
(1)加等体积饱和酚,混匀,以12 000 r/min的转速在室温条件下离心5 min。
(2)取上清液,加等体积氯仿,混匀,以12 000 r/min的转速在室温条件下离心5 min。
(3)取上清液,加等体积13%PEG 8 000,置冰上放置30 min。
(4)以12 000 r/min的转速在室温条件下离心10 min,弃上清液,用TE溶解备用。
3.DNA电泳检测
(1)用1×TAE配制0.7%的琼脂糖凝胶。
(2)置微波炉中加热至沸腾。
(3)按1 ng/100 mL的量加入溴化乙啶。
(4)待稍冷却后倒入胶槽中,制备DNA检测用凝胶。
(5)待凝胶完全凝固后.将凝胶放入电泳槽中。在电泳槽中加入1×TAE至液面恰好漫过凝胶表面。
(6)吸取10μL DNA样品与1μL 10×电泳样品缓冲液混匀。
(7)将样品加入凝胶的样品孔中。
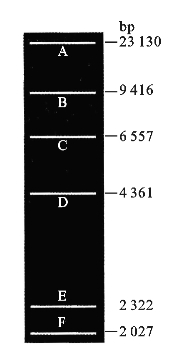
图3-3 λ Hind Ⅲ marker电泳示意图谱
(8)在实验组样品旁的样品孔中加入5μL DNA Marker(图3-3)。
(9)在加样孔侧接负电极,相反方向接正电极,以5 V/cm的恒定电压电泳。
(10)电泳结束后,将凝胶取出,置紫外暗箱观察DNA样品的电泳情况,进行记录或拍照。
五、实验结果
绘图表示质粒的电泳情况,并依据DNA Marker判断片段的大小。
六、注意问题
所用离心管及枪头在使用前必须灭菌。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




