一、实验目的
(1)掌握多管发酵法检测水中大肠菌群的方法。
(2)了解大肠菌群数量在饮用水中的意义及其生化特性。
二、基本原理
水中致病菌的数量较少,检测难度很大。大肠菌群是人和动物体内的正常菌群,在水中的数量与致病菌的数量呈正相关,而且大肠菌群的数量比较多,比较容易检测,所以,通常用大肠菌群的数量作为水的细菌学卫生标准。大肠菌群是一群好氧和兼性厌氧、革兰氏阴性、无芽孢的杆状细菌,在乳糖培养基中于37℃培养24~48 h能产酸产气(很多其他的细菌无此现象)。据水中大肠菌群的数量可以判断水源是否被粪便污染,并可间接推测水源受肠道病原菌污染的可能性。在乳糖培养基中倒置一支德汉氏小套管收集产生的气体。在培养基内加溴甲酚紫作为指示剂,细菌产酸后,培养基即由原来的紫色变为黄色。据此来鉴别水中的大肠菌群,再结合一定的技术手段,借助专门的统计表,就能得到水中的大肠菌群数量。
我国规定每升生活饮用水中大肠菌群数不能超过3个;若只经过加氯消毒即供作生活饮用水的水源水,大肠菌群数平均1 mL不得超过1 000个;经过净化处理及加氯消毒后供作生活饮用水的水源水,其大肠菌群数平均1 mL不得超过10 000个。
总大肠菌群的检测方法主要有多管发酵法(MPN法)和滤膜法。多管发酵法被称为水的标准分析法,即将一定量的样品接种到乳糖发酵管,据发酵反应的结果,确定大肠菌群的阳性管数后,在检索表中查出大肠菌群的近似值。该法较复杂。多管发酵法适用于饮用水、水源水,尤其是混浊度高的水中总大肠菌群的测定。滤膜法是一种快速的替代方法,能测定大体积的水样,但只局限于饮用水或较洁净的水。目前,在一些大城市的水厂常采用滤膜法。本实验用多管发酵法检测水中大肠菌群。
多管发酵法检测大肠菌群的数量一般分为3步:初发酵试验,平板分离,复发酵试验。
1.初发酵试验
将水样接种于发酵管内,37℃下培养,24 h内小套管中有气泡生成,并且培养基混浊,颜色改变,说明水中存在大肠杆菌,结果阳性。但也有产酸不产气和48 h后才产气的现象,这就需要做平板分离和复发酵试验,才能确定是否属大肠菌群。
2.平板分离
经24 h培养后,将产酸产气的发酵管,分别划线接种于伊红-亚甲蓝琼脂平板上,在于37℃培养箱内培养18~24 h。将符合下列特征的菌落的一部分,进行涂片、革兰氏染色、镜检:深紫黑色,有金属光泽;紫黑(绿)色、不带或略带金属光泽;淡紫红色、中心颜色较深;紫红色。
3.复发酵试验
经涂片、染色、镜检,如为革兰氏阴性无芽孢杆菌,则挑取该菌落的另一部分,重新接种于普通浓度的乳糖胆盐发酵管中,每管可接种来自同一初发酵管的同类型菌落1~3个,37℃培养24 h。结果若产酸又产气,即证实有大肠菌群存在。根据初步发酵的大肠菌群存在的发酵管数,查阅专门的统计表,得到大肠菌群数量。
三、实验器材
1.试剂
(1)蛋白胨,牛肉膏,乳糖,氯化钠,质量浓度为16 g/L的溴甲酚乙醇溶液,蒸馏水,磷酸氢二钾,琼脂,无水亚硫酸钠,质量浓度为50 g/L碱性品红乙醇溶液,质量浓度为20 g/L的伊红水溶液及质量浓度为5 g/L的亚甲蓝水溶液,质量浓度为100 g/L的氢氧化钠溶液、体积分数为10%的盐酸(原液为36%),精密pH试纸(6.4~8.4),质量浓度为15 g/L的硫代硫酸钠溶液,灭菌水等。
(2)自来水(或受粪便污染的河、湖水):400 mL。
2.染色剂
革兰氏染色液:草酸铵结晶紫,革兰氏碘液,体积分数为95%的乙醇、番红染液。
3.仪器及其他用具
高压蒸汽灭菌器,恒温培养箱,显微镜,锥形瓶(500 mL)1个,试管(18 mm×180 mm)6~7支,移液管1 mL的2支和10 mL的1支,带玻璃瓶塞,培养皿10套,接种环1个,试管架1个,吸管,乳糖胆盐发酵管,三倍浓缩乳糖蛋白胨发酵管(瓶)(内有倒置小倒管)等。
四、实验准备
(一)培养基配制
1.乳糖蛋白胨培养基(初发酵、复发酵使用)
蛋白胨10 g,牛肉膏3 g,乳糖5 g,氯化钠5 g,质量浓度为16 g/L的溴甲酚乙醇溶液1 mL,蒸馏水1 000 mL,pH为7.2~7.4。为了抑制革兰氏阳性菌生长,促进革兰氏阴性菌生长,配制时往往加入胆盐(3 g/L)。
分别称量上述各组分,加热溶解于1 000 mL蒸馏水,pH调至7.2~7.4;加入溴甲酚紫乙醇溶液1 mL,混匀;每管10 mL分装于试管中;取一小倒管倒放入试管内;管口塞上棉塞,包装,置于高压灭菌器115℃、压力0.072 MPa灭菌20 min;取出放于阴凉处备用。
2.三倍浓缩乳糖蛋白胨培养液(供初发酵用)
按上述乳糖蛋白胨培养基的配方,浓缩3倍配制,每试管装5 mL(初发酵时加入10 mL水样);也可配制双料乳糖蛋白胨培养液,每试管装10 mL(初发酵时加入10 mL水样)。在每管内倒放一个小倒管,管口塞好棉塞,包装,灭菌(115℃、0.072 MPa)20 min。
为节省时间,也可购买商品乳糖蛋白胨脱水培养基,较方便。
3.伊红-亚甲蓝培养基(供平板划线用)
(1)组分:蛋白胨10 g,乳糖10 g,磷酸氢二钾2 g,琼脂20~30 g,蒸馏水1 000 mL,质量浓度为20 g/L的伊红水溶液20 mL,质量浓度为5 g/L的亚甲蓝水溶液13 mL。(https://www.xing528.com)
(2)配制:将蛋白胨、磷酸氢二钾、琼脂按上述份额称量、溶解于1 000 mL蒸馏水,调整pH为7.2,加入乳糖,溶解、混匀、分装,在0.072 MPa、115℃条件下用高压灭菌器灭菌,待用。使用前加热融化培养基,冷却至50℃~55℃时,加入伊红和亚甲蓝水溶液,混匀,倒平板。
目前,伊红-亚甲蓝培养基在市面上也有销售,使用方便。
(二)水样收集
1.自来水采集
自来水采集时先将水龙头用火焰烧灼3 min,放水5 min,以无菌三角烧瓶接取水样。
若经氯处理的水中含有余氯,会减少水中细菌数量,采样瓶在灭菌前需加入硫代硫酸钠,以消除余氯。硫代硫酸钠的用量据采样瓶容量而定。若容量瓶500 mL,加入质量浓度为15 g/L的硫代硫酸钠溶液1.5 mL,可消除质量浓度为2 mg/L的450 mL水样中的全部氯量。
2.湖、河、井水、海水的采集
将灭菌的带玻璃塞瓶的瓶口向下浸入池水、井水、海水、河水或湖水中距水面10~15 cm的深层,然后翻转过来,除去玻璃塞。盛满水后,将瓶塞塞好,再从水中取出。水样须立即进行检测。
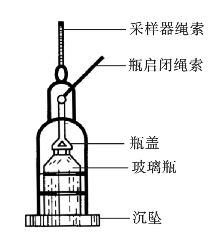
图2-4 采样器
也可用特制的采样器。采样器有很多种类,图2-4是其中一种。该采样器是一金属框,内装玻璃瓶,其底部装有重沉坠,可据需要下沉到一定深度。瓶盖上系有绳索,拉起绳索,即可打开瓶盖;松开绳索,瓶盖即自行塞好瓶口。水样采集后将水样瓶取出。若测定好氧微生物,则应立即改换无菌棉花塞。
(三)水样的处理
水样采集后,应迅速送回实验室马上检验。若不立即检验,则应放在4℃冰箱内保存。若无低温保存条件,则应在报告中标注水样采集与检验间隔时间。较清洁的水可在12 h以内检测,污水要在6 h内完成检测。
五、实验步骤
1.生活饮用水中大肠菌群的测定
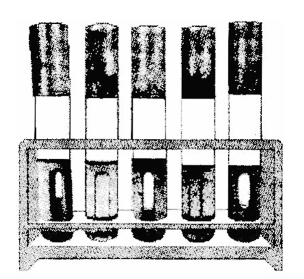
图2-5 MPN法测定大肠菌群初发酵的结果
(1)初发酵试验:对已经处理过的出厂自来水,需经常检验或每天检验一次的,可做5份10 mL的水样,即通过无菌操作在5支装有5 mL 3倍乳糖蛋白胨培养液的发酵管(或10 mL双料乳糖蛋白胨培养液)中各加入10 mL水样,混匀后置于37℃恒温箱中培养24 h,观察其产酸产气情况(图2-5)。
结果分析:①若培养基紫色,没变为黄色,说明不产酸;小倒管没有气体,说明不产气。此为阴性反应,表明水中无大肠菌群。②若培养基由紫色变为黄色,小倒管有气体,说明产酸产气。此为阳性反应,表明水中有大肠菌群。③若培养基由紫色变为黄色,说明产酸;小倒管没有气体,说明不产气。此仍为阳性反应,表明水中有大肠菌群。④若小倒管有气体,培养基为紫色,也不混浊,说明操作有问题,应重做检验。
结果为阳性,说明水可能被粪便污染,需进一步检验。
(2)确定性实验:用平板划线分离,将培养24 h后产酸(培养基呈黄色)、产气或只产酸而不产气的发酵管取出,通过无菌操作,用接种环挑取一环发酵液于伊红-亚甲蓝培养基平板上划线分离;共做3个平板。将已接种的平板置于恒温培养箱在37℃下培养18~24 h,观察菌落特征。若平板上长出的菌落具备如下特征,经涂片和革兰氏染色,结果为革兰氏阴性的无芽孢杆菌,则表示水中有大肠菌群。
大肠菌群在伊红-亚甲蓝培养基平板上具有的菌落特征:①深紫黑色,具有金属光泽的菌落;②紫黑(绿)色,湿润光亮,不带或略带金属光泽的菌落;③淡紫红色,中心色较深的菌落;④紫红色的菌落。
(3)复发酵试验:通过无菌操作,用接种环挑取有上述菌落特征、革兰氏阴性的菌落接种于装有10 mL普通浓度的发酵培养基内,每管可挑取同一平板上(即同一初发酵管)的1~3个典型菌落的细菌。将接种的培养基置于恒温培养箱37℃培养24 h,有产酸、产气者证明有大肠菌群,该发酵管则为阳性管。据阳性管数及实验所用的水样量,即可运用数理统计原理计算出每100 mL(或每升)水样中大肠菌群的最大可能数目(most probable number,MPN),见下式:
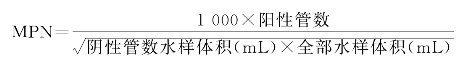
MPN的数据并非水中实际大肠菌群的绝对浓度,而是浓度的值。为了便于使用,现已制成检索表。根据证实有大肠杆菌群存在的阳性管(瓶)数可直接查阅检索表(附录七中附录-表5),即得结果。
2.水源水中大肠菌群的测定方法之一
(1)稀释水样:据水源水的清洁程度确定水样的稀释倍数。除了严重污染水外,一般稀释度可确定为10-1和10-2,稀释方法同实验2-7中水样稀释法。
(2)初发酵实验:以下均需无菌操作。用移液管吸取1 mL 10-2、10-1稀释水样及1 mL原水样,分别移至装有10 mL普通浓度乳糖蛋白胨培养基的发酵管中,另取10 mL原水样注入盛有5 mL 3倍浓缩乳糖蛋白胨培养基的发酵管中(若较清洁的水样,可再取100 mL水样注入盛有50 mL 3倍浓缩乳糖蛋白胨培养基的发酵瓶中)。将发酵管置于恒温培养箱37℃培养24 h,观察结果。之后实验步骤同生活饮用水的测定。
六、思考题
(1)利用多管发酵法检测大肠菌群的原理是什么?
(2)为何选用大肠菌群作为水的卫生指标?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




