一、实验目的
(1)通过实验掌握从各种环境(土壤、水体、活性污泥、垃圾、堆肥)中分离、稀释、浇注平板接种、培养微生物的方法。
(2)掌握稀释水样的方法。
(3)通过实验学会得到单一菌落的纯化分离方法。
二、实验原理
自然界中各种微生物混杂并存。我们在研究某种微生物时,必须先将它从混杂微生物中分离出来。稀释水样是为了降低水样中混杂生存的微生物浓度以便于分离。该实验的基本原理在于高度分散混菌,使单个微生物细胞在固体培养基上生长而形成单个菌落。
三、实验器材
(1)高压蒸汽灭菌器、生化恒温培养箱。
(2)玻璃器皿:250 mL三角瓶、16 cm试管、500 mL烧杯、移液管(1 mL、10 mL)、培养皿、玻璃棒等。
(3)废水、活性污泥、土壤悬液、湖水或河水1瓶。
(4)试剂:牛肉膏、蛋白胨、氯化钠、氢氧化钠、琼脂、pH试纸、蒸馏水(或无菌水)等。
(5)其他:天平、药匙、纱布、脱脂棉、牛皮纸、橡皮筋、酒精灯等。
四、实验步骤
1.牛肉膏蛋白胨培养基的制备
用天平分别称量牛肉膏0.75 g、蛋白胨2.5 g、氯化钠1.25 g、琼脂2.5~5 g,取蒸馏水250 mL(有时也可用自来水),依次加入烧杯中,混合后在电炉上加热,不断搅拌以免糊底,直至完全溶解。过滤去除沉淀,加水补足因加热蒸发的水量,倒入三角烧瓶中。120℃灭菌15~30 min,待用。
2.稀释水样
先用镊子取出一块酒精棉球擦手、镊子以及工作台,点燃酒精灯。(https://www.xing528.com)
将一瓶90 mL和数管(管数据实验数据而定,本次实验设5管)9 mL的无菌水排列好,按10-1、10-2、10-3、10-4、10-5、10-6依次编号。在无菌条件下,用10 mL的无菌移液管吸取10 mL水样或活性污泥(或其他样品10 g)置于第一瓶90 mL无菌水(内含玻璃珠)中,用移液管吹洗3次,手摇10 min(或用混合器)将颗粒状样品打散,即为10-1浓度的混合液。用1 mL无菌移液管吸取1 mL的10-1浓度的菌液于一管9 mL无菌水中,用移液管吹洗3次,摇匀后即为10-2浓度的菌液。同法依次稀释到10-6。稀释过程如图1-32所示。

图1-32 样品稀释过程
3.制作平板
(1)培养皿编号:取已灭菌的培养皿10套分别编号,10-4、10-5、10-6稀释度的菌液各3套,空气对照1套。
(2)加水样:取1支1 mL无菌移液管从稀释度小的10-6菌液开始,以10-6、10-5、10-4稀释度为序,分别吸取1 mL(或0.5 mL)菌液于相应编号的培养皿内(注:每次吸取前,用移液管在菌液中吹吸使菌液充分混匀)。也可以直接用微量移液枪移取菌液,每移一次换一个枪头。移取液体前,用70%乙醇对进入试管的枪体进行擦拭消毒。
(3)倒平板、接种:在酒精火焰附近将已灭菌且冷却至45℃左右的培养基倒入培养皿,10~15 mL/皿,培养基约占皿高的1/3~1/2。具体倒法:右手拿装有培养基的锥形瓶,左手拿培养皿(图1-33 A),以中指、无名指和小指托住皿底,拇指和食指将皿盖掀开,倒入培养基后将培养皿平放在桌上,顺时针和逆时针来回转动培养皿,使培养基和菌液充分混匀,冷凝后即成平板。将试管内培养基倒入培养皿制作平板可按图1-33 B操作。
(4)培养:倒置于37℃恒温箱内培养24~48小时,观察结果。
(5)对照样品倒平板、接种:取“对照”的无菌培养皿,倒平板。待培养基凝固后,打开皿盖10分钟后重新盖上,倒置于37℃恒温培养箱培养24~48小时,观察结果。
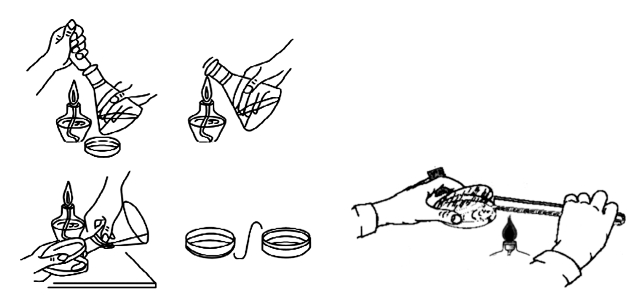
图1-33 倒平板示意图
A.从锥形瓶倒入培养皿;B.从试管倒入培养皿
五、思考题
(1)用一根无菌移液管接种几种浓度的水样时,应先从哪个浓度开始?说明原因。
(2)用平板分离纯化菌种时,为何要反复挑取单个菌落置于斜面培养基上培养?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




