1.实验设置
为了进一步验证ETOP 作为等离子体剂量的科学可行性,下面还开展了等离子体杀菌实验。在实验中,采用了四种不同的工作气体(包括纯He、He+0.5%O2、He+1%O2和He+0.2%H2O),以保证各类RONS之间的相对浓度存在显著差异。图7.3.3(a)给出了本实验采用的N-APPJ发生装置。该装置由石英管和细铜环电极制成,管长为10cm,内径为0.3cm。石英管外部接有环形高压电极,其上连接纳秒脉冲电压。其中,电压幅值为8kV,脉冲频率为8kHz,上升时间为84ns。图7.3.3(c)给出了纯He等离子体的外施电压和电流波形。
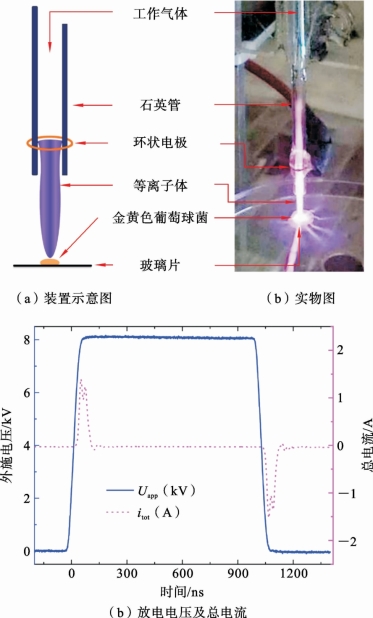
图7.3.3 等离子体射流装置图和放电特性
对于灭菌实验,首先将10μL的金黄色葡萄球菌溶液(108CFU/mL)均匀地铺在直径7mm 的玻璃片上。然后将样品放在无菌环境中静置20min。待其表面干燥后,实验组将细菌样品置于射流喷嘴处1cm 的位置,并用等离子体处理5min、8min、10min、15min。对照组不接受等离子体处理。此后,将细菌样品置于5mL水中浸泡15min。随之将细菌悬浮液稀释至不同的梯度,然后取100μL均匀涂在琼脂平板(直径为9cm)上,培养48h后统计CFU 并计算得到BRF。
对于RONS测量,由于实验条件限制,仅对NO2、NO、O3、O 和OH 进行了绝对浓度测量。其中,NO2和NO 由气体检测器测量,NO2和NO 的分辨率分别为0.1ppm 和1ppm。O3和NOx测量系统如图7.3.4(a)所示,由一个标准的紫外线光源和一个单色仪组成,其中,单色仪的入口和出口狭缝均设置为10μm,波长设置为254nm。平均O3绝对浓度可以通过以下公式计算[81]:

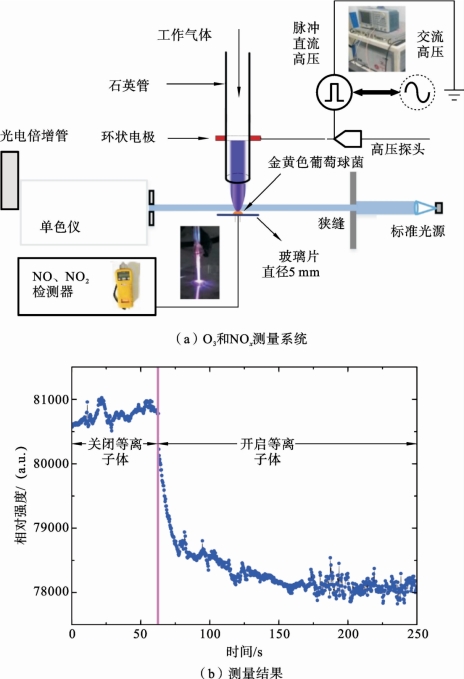
图7.3.4 O3与NOx的测量系统及在254nm 处的光强测量结果(He+0.5%O2)
式中:T 是气体温度(K);P 是压强(atm);f 是254nm 下O3的吸收系数,其值为134cm-1·atm-1;l是吸收长度;It和I0分别为有和无等离子体时在254nm 处的稳定光强。
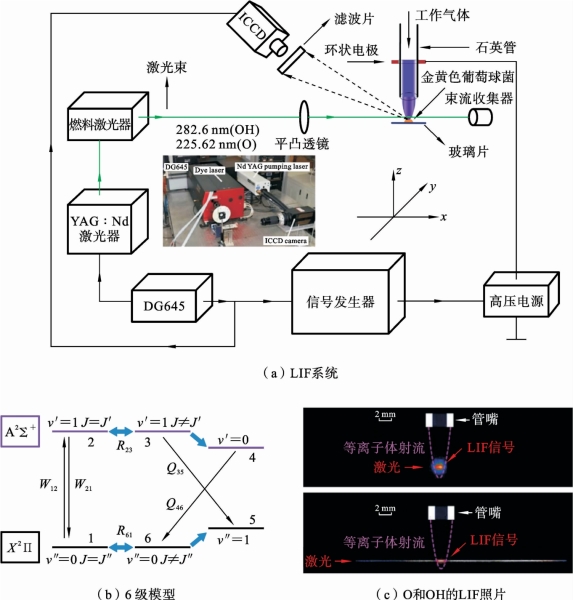
图7.3.5 OH 和O 激光诱导荧光系统示意图
图7.3.5(a)给出了用于OH 和O 测量的激光诱导荧光(LIF)系统的示意图。激光聚焦在样品上方1mm 的位置。在垂直于激光束(y 方向)的方向,通过ICCD 摄像机捕获荧光信号(镜头前置窄带滤光片,OH 为λ0=309nm,O为λ0=845nm,FWHM=10nm)。OH 的绝对密度采用瑞利散射标定。为了提高结果的准确性,基于6级LIF 模型考虑了OH 转动和振动能级跃迁的影响[82,83],如图7.3.5(b)所示。O 原子密度则通过双光子吸收激光诱导的荧光(TALIF)进行测量,其中TALIF信号通过Xe气体标定[67]。图7.3.5(c)给出的是OH 和O 的诱导荧光信号。
2.仿真方法
由于受诊断条件的限制,因此下面进一步开发等离子体射流模拟程序来获得其他难以诊断的RONS浓度。该等离子体射流仿真基于流体建模,通过计算Poission方程、粒子传输方程及能量守恒方程来模拟等离子体[58,84]。该模型涉及的粒子数达45种,反应则超过300个,均来自参考文献[78]。通过碰撞截面/Arrhenius公式计算反应速率。对于二维模型,在计算等离子体时耦合了气流,其中,He气流速及空气摩尔分布通过Navier-Stokes方程和对流扩散方程[85,86]计算。
图7.3.6(a)所示的为前6个脉冲周期内的模拟电子密度。峰值电子密度接近1.3×1019m-3,与已发表的实验和模拟结果一致[85,87~88]。图7.3.6(b)给出了长曝光的等离子体照片(曝光时间为1s)与模拟电子密度分布的比较,两者均证实了环状的等离子体通道分布[87]。(https://www.xing528.com)
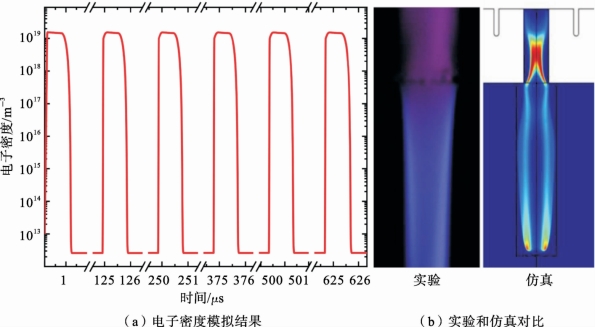
图7.3.6 电子密度模拟结果及长曝光(1s)的等离子体射流实验和仿真的对比
3.仿真结果
图7.3.7(a)所示的为不同工作气体组分下的RONS数密度的诊断结果。可以发现,不同工作气体中RONS的浓度存在显著差异。另外,不同于kINPen®和FlatPlaster,对于纳秒脉冲等离子体射流,NO2的密度更高,这主要由NO 与O 的复合导致(模拟反应速率高达3.52×102mol/(m3·s))。较低的气体湿度同样有助于产生更多的NO2。随着O2含量的增加,以O 和O2的复合主导的O3(O+O2+M→O3+M)[89]具有比NO2更快的增长速率。对于He+0.2%H2O 等离子体,与纯He相比,NO2和NO 的密度略有降低,而OH的密度则由于电子分解反应(e+H2O→e+OH+H)显著增加。图7.3.7(b)给出了模拟的RONS密度(He+0.5%O2),其结果不仅与测量结果一致,而且与已发表的文献结果相同[58,90~91]。
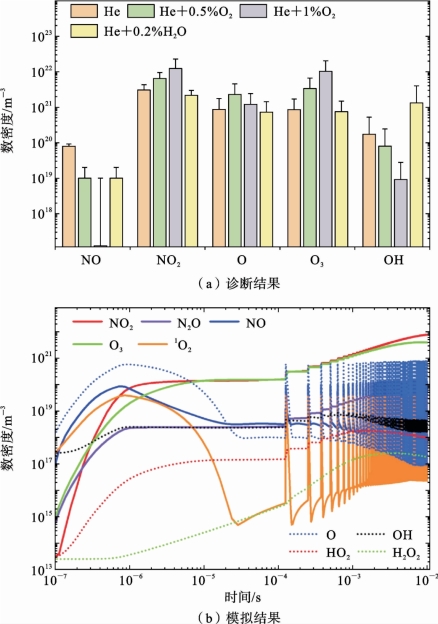
图7.3.7 RONS 浓度实验诊断和数值模拟结果
CFU、BRF 及对应的ETOP 的计算结果在表7.3.1中列出。随着等离子体处理时间的增加,培养基上金黄色葡萄球菌菌落数逐渐减少。实验结果进一步表明,纯He和He+0.2%H2O 等离子体具有最佳的杀菌效果,而在He+0.5%O2和He+1%O2这两种条件下,等离子体处理15min后的BRF 仅降低了2.42和1.10个对数单位。有趣的是,上述结果与等离子体处理干蛋壳上细菌的结果近乎一致[66]。因此,为了进一步确认湿度对等离子体灭活的影响,实验时还使用相同的等离子体装置处理15 min 接种了100μL(108 CFU/mL)金黄色葡萄球菌溶液的新鲜培养基,从图7.3.8可发现,He+0.5%O2等离子体具有最大面积的除菌能力,这也与以前研究结果一致[92]。因此,在潮湿条件下,需要进一步对ETOP 进行优化,这是因为此时RONS首先需要溶解到液体中形成新的活性成分才能作用于细胞[93~95]。更多关于如何在液相中定义ETOP 将在“讨论”部分中展开。
表7.3.1 CFU、BRF 及对应的ETOP 计算结果
图7.3.8 等离子体直接处理的涂有100μL金黄色葡萄球菌溶液新鲜培养基的实验结果
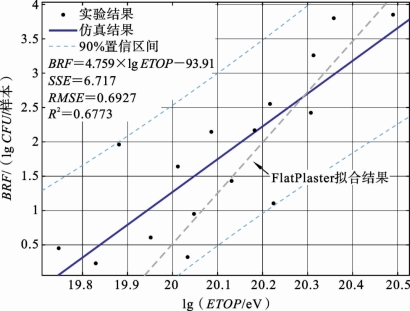
图7.3.9 本实验ETOP 与BRF 的拟合结果
根据实验除菌结果及实验和模拟所得的RONS密度,即可计算得到BRF及对应的ETOP。图7.3.9所示为它们之间关系的拟合结果。尽管He+1%O2等离子体的O3和NO2浓度高于其他工作气体下的等离子体,但其等离子体射流直径减小导致等离子体横截面变小,从而导致最终的ETOP 计算结果更小。从图7.3.9可以看出,尽管不同工作气体下的等离子体RONS密度存在差异,然而,BRF 和ETOP 之间的正相关趋势没有变化,统计指标SSE=6.717,RMSE=0.6927,R2=0.6773表明模型误差总体上可以接受。通过与FlatPlaster的拟合结果进行比较,可以发现,对于重叠部分的lgETOP(20至20.5之间),该装置的灭活效率仍在本装置拟合结果的置信区间之内,这再次验证了ETOP 作为剂量的可行性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




