1.细胞培养
本节中L02细胞的培养方法与6.3 节中的方法相同,本节实验中使用的细胞松弛素B、Giemsa染液、6-硫代鸟嘌呤(6-TG)分别从生物医药公司购买。
2.实验装置与细胞处理
本节实验所用的N-APPJ装置和放电参数与6.4节的保持一致,不同的是,由于本节中N-APPJ处理后的细胞需要继续传代培养许多代,因此实验中没有处理贴壁后的细胞,而是处理细胞悬液,具体实验装置如图6.5.1所示。
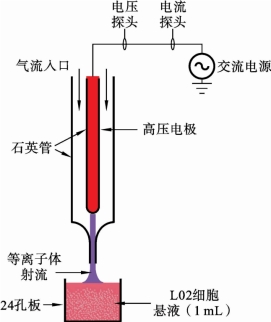
图6.5.1 N-APPJ处理L02细胞示意图[62]
N-APPJ处理前,将处于对数生长期的细胞用胰蛋白酶消化后加入完全培养基轻轻吹打,形成细胞悬液,再用血球计数板对细胞悬液中的细胞个数进行计数,并将细胞浓度调整成106/mL。之后将1 mL 细胞悬液加入到24孔板中,用等离子体射流对细胞进行第一轮不同时间梯度(0.5min、1min、5min、10min、20min和30min)的处理。在等离子体射流的实际应用中单次直接处理30min是个相当长的时间,因此将处理时间30 min设为本实验的极端情况。第一轮处理后的细胞被进行细胞凋亡检测、微核试验和HPRT 基因突变检测。除此之外,处理时间为30min 组的存活细胞继续在细胞培养箱中传代培养7代(细胞分裂约20次),然后再一次对后代L02细胞进行第二轮等离子体射流处理,处理时间分别为5min、10min、20min和30min。最后对第二轮处理后的细胞再次进行相同的检测,以研究等离子体射流对L02细胞产生的损伤是同样具有类似辐射处理的远后效应。整个实验流程图如图6.5.2所示。
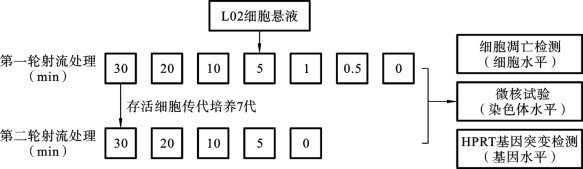
图6.5.2 等离子体射流对L02细胞遗传毒性和诱变特性研究流程图[62]
3.检测方法(https://www.xing528.com)
L02细胞在N-APPJ处理后的凋亡情况使用AnnexinV-FITC/PI细胞凋亡检测试剂盒进行检测。具体地,在实验中,N-APPJ处理后的细胞悬液放入6孔板中培养24h后,用不含EDTA 的胰蛋白酶消化收集细胞至少105个细胞,收集时培养液中及漂浮的死细胞也要一并收集。收集细胞后加入500μL试剂盒中的结合缓冲液(bindingbuffer)重悬细胞,之后再分别加入5μL 的AnnexinV-FITC和5μLPI,混匀后室温下避光反应10min,最后用流式细胞仪(BDLSRFortessa,USA)进行细胞凋亡检测。
L02细胞在N-APPJ处理后的微核率(micronucleus frequency,MNF)采用细胞分裂阻滞微核分析法(cytokinesis-block micronucleus assay,CBMN assay)进行检测。该方法利用胞质分裂阻滞剂(如细胞松弛素)阻断细胞的胞质分裂,但不影响细胞核的正常分裂,因此分裂后的细胞会呈现双核状态。通过统计双核细胞中出现微核的细胞个数占统计双核细胞的比例便可以得到细胞的微核率。微核率越高则表示细胞受到的遗传损伤程度越高。最终的微核率按照式(6.5.1)进行计算:
![]()
式中:M1、M2、M3和M4分别为统计的双核细胞总数N(本章中N 取1000)中含有1个、2个、3个和4个微核的双核细胞个数。
L02细胞的HPRT 基因突变频率主要通过在细胞培养基中加入6-硫代鸟嘌呤(6-TG)的方法得到。其基本原理是正常细胞在含有6-TG 的培养基中培养时,6-TG 可以掺入细胞DNA,导致细胞死亡。但是如果细胞的HPRT 基因发生突变,便能够抵抗6-TG 的毒性,从而可以在含有6-TG 的细胞培养基中存活。通过统计存活下来的细胞最终形成的细胞克隆数与最初接种细胞数之间的比值便得到HPRT 基因的突变频率。具体的HPRT 基因突变频率(mutation frequency,MF)最终由式(6.5.2)计算得到:
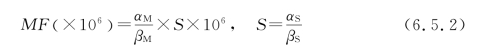
式中:αM是突变检测中最终形成的细胞克隆数;βM 是突变检测一开始接种细胞数;S 是L02细胞的克隆形成率;αS和βS 是L02细胞克隆形成率实验中最终形成的细胞克隆数和接种细胞数。
关于以上检测方法的具体操作步骤可参考文献[6]。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




