实验装置示意图如图5.3.1所示。将冷冻的猪里脊肌肉组织用切片机切成500μm、750μm、1250μm 和1500μm 四种厚度的薄片,将不同厚度组织切片放在装有不同种类溶液的接收室顶部。实验时确保接收室内的液体与组织切片良好接触。然后采用大气压非平衡等离子体射流进行处理,大气压非平衡等离子体射流由交流电源驱动,工作气体为流速2L/min的氦气(He)混合0.5%氧气(O2),实验用交流电压峰-峰值为16kV,频率为8kHz,电压与放电电流波形如图5.3.1所示。

图5.3.1 等离子体射流实验装置图及放电电压、电流波形图[16]
产生等离子体射流的喷嘴与组织切片上表面间距固定为5 mm,选择5min、10min和20min三个时间梯度进行处理。为保证液体中RONS的均匀分布,液体内置一颗小磁力转子,并在处理过程中使用磁力搅拌器搅拌液体。处理结束后,等候5min使渗入组织中的活性粒子充分渗入接收液中,再取接收室中液体采用化学法测量其中的过氧化氢(H2O2)、硝酸根(![]() )和亚硝酸根(
)和亚硝酸根(![]() )粒子浓度,具体实验细节读者可参考文献[16]。
)粒子浓度,具体实验细节读者可参考文献[16]。
大气压非平衡等离子体射流处理后,穿透不同厚度的肌肉组织切片渗入接收液中的H2O2浓度如图5.3.2所示。当接收池中液体为双蒸水时,如图5.3.2(a)所示,接收液中H2O2粒子浓度随等离子体处理时间增加非线性增加。当接收室上覆盖的组织厚度为500μm 时,渗透进接收液的过氧化氢粒子浓度约为覆盖组织厚度为750μm 时的2倍;而当覆盖组织切片厚度进一步增加到1250μm 和1500μm 时,渗透进接收液的过氧化氢浓度急速降低为2~5μmol/L,约为覆盖组织切片厚度为500μm 时的1/10;当覆盖组织切片厚度再增加到2000μm 时,接收液中H2O2浓度低于检测极限。
图5.3.2(b)给出了接收液为PBS时,等离子处理后,渗透不同厚度猪肌肉组织切片进入1%PBS接收液中的H2O2浓度。相较于图5.3.2(a)所示的双蒸水中的H2O2浓度,相同处理时间和覆盖组织厚度下,PBS 接收液中H2O2浓度更高,这种情况在覆盖组织厚度为500μm 的情况下尤为明显。覆盖相同厚度的组织,处理时间为20min时,PBS接收液中H2O2浓度高达60 μmol/L而DDW 中H2O2浓度低于20μmol/L。另外需要注意到的一点是处理时间从10min变到20min,接收液中H2O2浓度的增加并不是非常明显。
图5.3.2(c)为生理盐水作为接收液时,不同厚度组织切片和不同处理时间下,接收液中H2O2含量。同图5.3.2(a)与图5.3.2(b)比较,相同实验条件下,生理盐水接收液中H2O2浓度高于DDW 而低于PBS溶液中。这可能会与生理盐水中存在较高浓度的Cl-有关。
图5.3.2(d)所示为5%葡萄糖溶液作为接收液情况下,不同处理时间,穿过不同厚度猪肌肉组织进入接收室中的H2O2浓度。相同处理时间,覆盖组织厚度为500μm 时,进入葡萄糖接收液中H2O2浓度为450μmol/L,约为同条件下双蒸水接收液中测量得到的H2O2浓度的20倍以上;当覆盖组织厚度增加到750μm 甚至更厚,进入接收液的H2O2浓度大大降低,这与另外几种情况下H2O2浓度变化规律相同。不过还需要注意一点是,覆盖组织厚度为500μm,处理时间为10min或者20min,测量得到的H2O2浓度较5min处理时间的情况急速增加。
图5.3.2(e)与图5.3.2(f)显示了用1%PBS溶液稀释后的人血清作为接收液,测量透过组织的H2O2浓度的结果。从图5.3.2(e)可以看出,与葡萄糖溶液作为接收液结果类似,500μm 厚度的覆盖组织条件下,人血清接收液中H2O2浓度远高于双蒸水接收液中H2O2浓度;同样当覆盖组织厚度增加,接收液中H2O2浓度骤减。而从图5.3.2(f)可见,10%人血清作为接收液,其中H2O2浓度比2%人血清接收液中的浓度低,但是依旧高于同等实验条件下的双蒸水接收液中H2O2浓度。

图5.3.2 等离子体射流处理后,穿透不同厚度的肌肉组织切片渗入接收液中的H2O2浓度[16]
图5.3.3则给出了大气压非平衡等离子体射流直接处理后,不同接收液中H2O2的浓度。可以看出,等离子直接处理情况下,无机组(双蒸水、1%磷酸盐缓冲液、0.9% NaCl溶液)的三种接收液中H2O2浓度在同一数量级,而三种有机溶液(5%葡萄糖溶液、2%人血清溶液、10%人血清溶液)中的H2O2含量明显较无机组接收液中高约1个数量级。这表明等离子体可与溶液中有机成分反应促进H2O2生成。

图5.3.3 不同处理时间下等离子体射流直接处理各种接收液中H2O2的浓度[16]
大气压非平衡等离子体射流处理后,穿透不同厚度的肌肉组织薄片渗入接收液中的![]() 浓度如图5.3.4所示。
浓度如图5.3.4所示。
图5.3.4(a)为双蒸水接收液情况下,测量的![]() 含量。结果显示覆盖组织厚度为500μm 时,随着处理时间从10min增加到20min,
含量。结果显示覆盖组织厚度为500μm 时,随着处理时间从10min增加到20min,![]() 含量从(25±5)μmol/L激增至(75±5)μmol/L;而当覆盖组织厚度增加,
含量从(25±5)μmol/L激增至(75±5)μmol/L;而当覆盖组织厚度增加,![]() 浓度明显降低。
浓度明显降低。
图5.3.4(b)给出了接收液为1%PBS溶液时,不同处理时间和覆盖组织厚度下测量所得![]() 浓度。从图中可见,每个实验条件下测量得到的
浓度。从图中可见,每个实验条件下测量得到的![]() 浓度均高于同等实验条件下双蒸水接收液中测量得到的
浓度均高于同等实验条件下双蒸水接收液中测量得到的![]() 浓度。当覆盖组织厚度高达2000μm 时,穿透肌肉组织进入接收液的
浓度。当覆盖组织厚度高达2000μm 时,穿透肌肉组织进入接收液的![]() 浓度低于检测极限。(https://www.xing528.com)
浓度低于检测极限。(https://www.xing528.com)
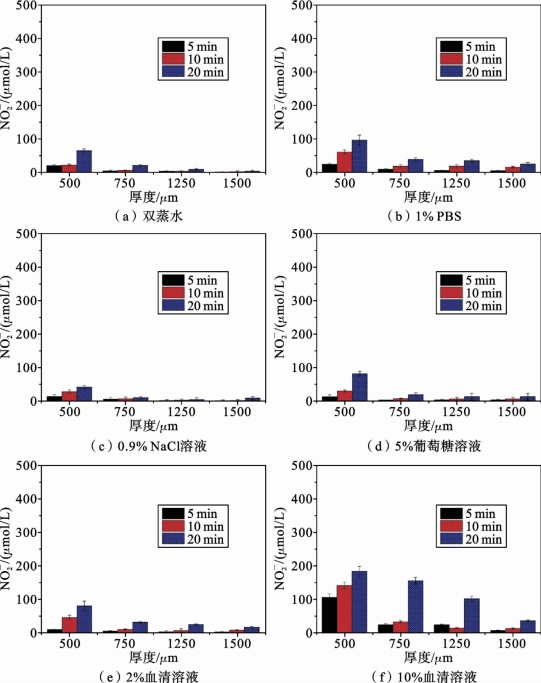
图5.3.4 等离子体射流处理后穿透不同厚度的肌肉组织切片渗入接收液中的N 浓度[16]
浓度[16]
图5.3.4(c)为接收液是0.9% NaCl溶液时,等离子体处理后,其中的![]() 浓度。其与处理时间和覆盖组织厚度的相关性类似于1% PBS接收液中的情况。比较图5.3.4(b)和图5.3.4(c)的结果可以看出,在相同条件下,0.9% NaCl溶液中的
浓度。其与处理时间和覆盖组织厚度的相关性类似于1% PBS接收液中的情况。比较图5.3.4(b)和图5.3.4(c)的结果可以看出,在相同条件下,0.9% NaCl溶液中的![]() 浓度低于1% PBS溶液中浓度,且低于相同条件下双蒸水中的
浓度低于1% PBS溶液中浓度,且低于相同条件下双蒸水中的![]() 浓度。
浓度。
图5.3.4(d)、图5.3.4(e)以及图5.3.4(f)分别给出了5%葡萄糖溶液作为接收液和2%、10%人血清溶液作为接收液时,等离子体处理后其中![]() 的浓度。由图5.3.4(d)可见,5%葡萄糖溶液中
的浓度。由图5.3.4(d)可见,5%葡萄糖溶液中![]() 浓度与处理时间和覆盖组织厚度的相关性与双蒸水接收液中类似。而图5.3.4(e)与图5.3.4(f)所示结果则表明,人血清作为接收液,尤其是10%人血清接收液中
浓度与处理时间和覆盖组织厚度的相关性与双蒸水接收液中类似。而图5.3.4(e)与图5.3.4(f)所示结果则表明,人血清作为接收液,尤其是10%人血清接收液中![]() 含量在相同实验条件下约为双蒸水接收液中的数倍。
含量在相同实验条件下约为双蒸水接收液中的数倍。
大气压非平衡等离子体射流直接处理接收液,不同处理时间下,各种接收液中![]() 的浓度如图5.3.5所示。从图中可以看出,随着处理时间增加,所有接收液中亚硝酸根离子含量均增加,但是相较于另外四种接收液,2%和10%人血清作为接收液在被大气压非平衡等离子体射流直接处理后,其中
的浓度如图5.3.5所示。从图中可以看出,随着处理时间增加,所有接收液中亚硝酸根离子含量均增加,但是相较于另外四种接收液,2%和10%人血清作为接收液在被大气压非平衡等离子体射流直接处理后,其中![]() 浓度随处理时间增加幅度更明显。
浓度随处理时间增加幅度更明显。
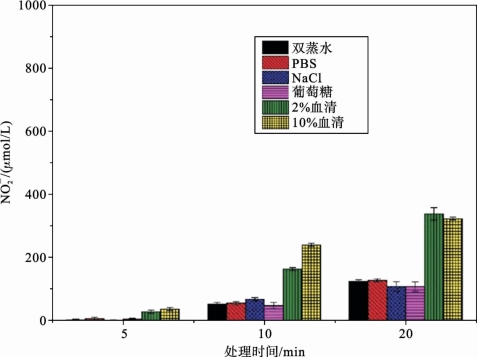
图5.3.5 不同处理时间下等离子体射流直接处理各种接收液中N 的浓度[16]
的浓度[16]
大气压非平衡等离子体射流处理后,穿透不同厚度的肌肉组织薄片渗入接收液中的![]() 浓度如图5.3.6所示。
浓度如图5.3.6所示。
图5.3.6(a)、图5.3.6(b)以及图5.3.6(c)分别给出了接收液为双蒸水、1%PBS溶液和0.9% NaCl溶液时,大气压非平衡等离子体射流处理后,渗透进入接收液的![]() 浓度。对比这三张图可以发现,覆盖500μm 组织薄片的情况下,双蒸水接收液中
浓度。对比这三张图可以发现,覆盖500μm 组织薄片的情况下,双蒸水接收液中![]() 含量在所有处理时间梯度下高于另外两种无机接收液中含量。这个现象在除1500μm 厚度组织覆盖外的其他实验条件下均存在。但覆盖组织厚度为1500μm 时,0.9% NaCl溶液中
含量在所有处理时间梯度下高于另外两种无机接收液中含量。这个现象在除1500μm 厚度组织覆盖外的其他实验条件下均存在。但覆盖组织厚度为1500μm 时,0.9% NaCl溶液中![]() 浓度在所有处理时间下均高于双蒸水接收液的情况。
浓度在所有处理时间下均高于双蒸水接收液的情况。

图5.3.6 大气压非平衡等离子体射流处理后,穿透不同厚度的肌肉组织切片渗入接收液中的N 浓度[16]
浓度[16]
图5.3.6(d)、图5.3.6(e)以及图5.3.6(f)所示为接收液是有机溶液时测量的![]() 浓度。可以发现,覆盖500μm 厚度肌肉组织时,5%葡萄糖溶液中渗透的
浓度。可以发现,覆盖500μm 厚度肌肉组织时,5%葡萄糖溶液中渗透的![]() 浓度略低于双蒸水中渗透入的
浓度略低于双蒸水中渗透入的![]() 浓度。若接收液为2%人血清溶液,透过500μm 厚度肌肉组织的
浓度。若接收液为2%人血清溶液,透过500μm 厚度肌肉组织的![]() 浓度在所有处理时间梯度下都远高于双蒸水接收液中的浓度,这一点在处理时间为10min和20min的情况下尤为明显;不过这种现象随着覆盖组织厚度的增加渐渐减弱。比较图5.3.6(e)与图5.3.5(f),可以看出当使用的人血清接收液浓度从2%增加到10%时,接收液中
浓度在所有处理时间梯度下都远高于双蒸水接收液中的浓度,这一点在处理时间为10min和20min的情况下尤为明显;不过这种现象随着覆盖组织厚度的增加渐渐减弱。比较图5.3.6(e)与图5.3.5(f),可以看出当使用的人血清接收液浓度从2%增加到10%时,接收液中![]() 浓度骤降。以覆盖500μm 厚度肌肉组织、等离子体处理20min的实验条件为例,
浓度骤降。以覆盖500μm 厚度肌肉组织、等离子体处理20min的实验条件为例,![]() 浓度从2%人血清接收液中的360μmol/L 降至10%人血清接收液中的160μmol/L,这甚至比同等实验条件下双蒸水接收液中
浓度从2%人血清接收液中的360μmol/L 降至10%人血清接收液中的160μmol/L,这甚至比同等实验条件下双蒸水接收液中![]() 浓度还要低。
浓度还要低。
大气压非平衡等离子体射流直接处理接收液,不同处理时间下,各种接收液中![]() 的浓度如图5.3.7所示。从图中可以看出,
的浓度如图5.3.7所示。从图中可以看出,![]() 浓度随处理时间的变化趋势与H2O2以及
浓度随处理时间的变化趋势与H2O2以及![]() 浓度的变化趋势相同,随着处理时间的增加浓度增大。在10%人血清接收液中,用等离子体射流处理10 min 或20 min,
浓度的变化趋势相同,随着处理时间的增加浓度增大。在10%人血清接收液中,用等离子体射流处理10 min 或20 min,![]() 浓度将远高于同等条件下在另外5种接收液中的情况。
浓度将远高于同等条件下在另外5种接收液中的情况。
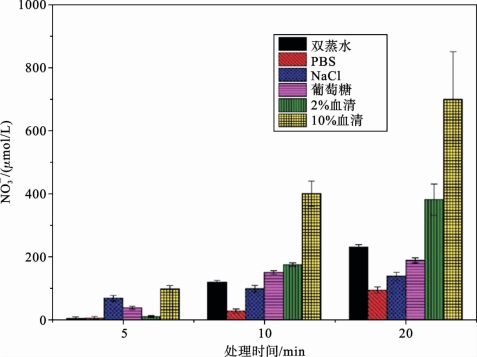
图5.3.7 不同处理时间下等离子体射流直接处理各种接收液中N 的浓度[16]
的浓度[16]
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




