不同的放电参数下,等离子体产生的活性粒子不尽相同。本研究将采用He和O2(He∶O2=2L/min∶0.02L/min)为工作气体,脉冲电压信号为8kV,8kHz,脉宽为1.0μs,在该放电参数下,其产生的活性粒子的主要成分是什么? 这些活性粒子能否进入细胞内? 对细胞会产生什么影响? 是否是细胞凋亡发生的直接原因? 为了进一步阐明这些问题,在本节中,用光谱仪、生物化学和免疫学实验方法,探索了等离子体中的活性粒子成分及其与HepG2细胞的作用方式,阐明了等离子体对细胞氧化/硝化应激及细胞的抗氧化体系的影响,以及与细胞凋亡的潜在关系。
1.等离子体的光谱分析
采用光谱仪实时观测上述放电参数下等离子体的发射光谱,诊断其产生的活性粒子。如图3.5.1 所示,所产生的等离子体中有大量处于激发态的OH、![]() 、He和O 等,这些激发态粒子寿命很短,它们会瞬间反应生成NO 和
、He和O 等,这些激发态粒子寿命很短,它们会瞬间反应生成NO 和![]() 等。因此可以知道,上述工作条件下产生的等离子体中的化学活性成分主要是活性氧粒子(如OH、O、
等。因此可以知道,上述工作条件下产生的等离子体中的化学活性成分主要是活性氧粒子(如OH、O、![]() 等)和活性氮粒子(如
等)和活性氮粒子(如![]() 、NO 等),而He为惰性气体,活性相对稳定,一般认为不会与生物体产生反应。
、NO 等),而He为惰性气体,活性相对稳定,一般认为不会与生物体产生反应。
2.大气压非平衡等离子体射流对HepG2细胞内氧化水平的影响
等离子体中含有大量的ROS(如OH、O、![]() )和RNS(如
)和RNS(如![]() 、NO),研究表明,这些活性粒子是一种重要的促氧化剂,可以通过引发细胞内氧化-抗氧化系统的失衡及氧化/硝化损伤诱导细胞凋亡。下面通过生物学方法对等离子体处理后细胞内外的ROS 及RNS 进行了检测,并对等离子体处理后HepG2细胞内的氧化水平进行评估。
、NO),研究表明,这些活性粒子是一种重要的促氧化剂,可以通过引发细胞内氧化-抗氧化系统的失衡及氧化/硝化损伤诱导细胞凋亡。下面通过生物学方法对等离子体处理后细胞内外的ROS 及RNS 进行了检测,并对等离子体处理后HepG2细胞内的氧化水平进行评估。

图3.5.1 典型的等离子体发射光谱[12]
活性氮粒子(如NO)的含量可以根据Griess比色法测定亚硝酸盐的浓度计算得出。等离子体处理细胞后,立刻收集细胞外液,并对NO 类物质进行了检测,结果如图3.5.2所示,与未处理的对照组相比,等离子体处理后的细胞外液NO 含量急剧上升,并在960s时达到最大值,约为对照组的1800倍。
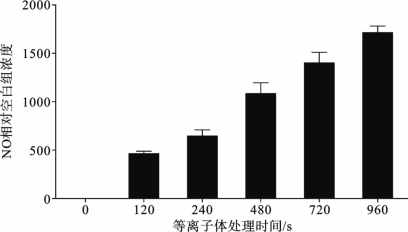
图3.5.2 等离子体处理后细胞外液NO 含量变化[13]
分别在等离子体处理后即刻及培养24h后,使用细胞裂解液对细胞进行裂解,对裂解产物进行NO 含量的检测,研究等离子体对细胞内NO 含量的影响。结果如图3.5.3所示,随着等离子体处理时间的增加,细胞内的NO 含量也明显上升,虽然上升的程度不如细胞外的NO 大,但是当处理时间达到960s时,其NO 的含量也达到了无处理对照组的27倍左右。而在细胞培养24h之后,各组细胞内的NO 含量发生了明显的下降,但是等离子处理组的NO 含量依然比无处理对照组的高。值得注意的是,960s处理组的NO 含量低于720s处理组,这可能是由于长时间处理引起的细胞死亡及细胞膜的破坏,从而使细胞内的NO 类物质向细胞外发生了渗漏。
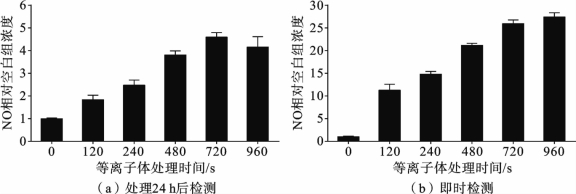
图3.5.3 等离子体处理对细胞内的NO 含量的影响[13]
活性粒子RNS寿命都相当短,然而如图3.5.3所示,在细胞经大气压非平衡等离子体射流处理并培养24h之后仍然可以检测到大量NO 类物质,因此,持久的RNS水平暗示大气压非平衡等离子体射流必然造成了细胞内长期的生理、生化变化。除了等离子体中的RNS扩散进入细胞并生成的相对稳定的活性氮副产物,是否还有其他影响细胞内RNS水平的机制呢? 细胞内NO的生成主要是由一氧化氮合成酶(nitricoxidesynthase,NOS)催化的,是细胞内RNS的主要来源。评估等离子体处理后,HepG2细胞内NOS的酶活力和细胞内iNOS 的表达情况,所得结果如图3.5.4 所示,细胞内诱导型NOS(iNOS)和组成型NOS(cNOS)的酶活力均有不同程度的提高,并具有等离子体剂量依赖效应。特别是iNOS的酶活力,当等离子体处理时间为720s时,iNOS的酶活力达到了对照组的1.5倍,有极显著差异。而cNOS的酶活力相对较低。WesternBlot进一步检测细胞内iNOS的表达,发现等离子体处理组中iNOS 的水平也有明显的上调。细胞内iNOS 和cNOS 酶活力的提高是24h后HepG2细胞内RNS积累的直接原因。
值得注意的是,NOS酶活力的提高与NO 的产生并不平衡,720s等离子体处理组中NOS酶活力为对照组的1.5倍,然而RNS的水平却达到了对照组的4.2倍。NO 的半衰期仅有几秒,能与细胞内超氧阴离子(![]() )迅速结合,生成稳定的过氧亚硝酸盐阴离子(ONOO-)。因此,细胞内高水平的RNS除了NOS合成的NO 外,也可能与等离子体中的RNS扩散入细胞,与
)迅速结合,生成稳定的过氧亚硝酸盐阴离子(ONOO-)。因此,细胞内高水平的RNS除了NOS合成的NO 外,也可能与等离子体中的RNS扩散入细胞,与![]() 结合生成稳定的ONOO-有关。
结合生成稳定的ONOO-有关。
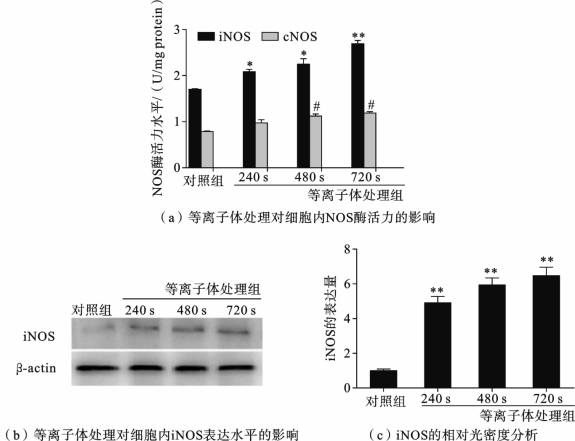
图3.5.4 大气压非平衡等离子体射流处理对HepG2细胞内iNOS活性及表达水平的影响[14]
*P<0.05,** P<0.01;n=3
除了NO 类物质外,ROS也是等离子体产生的一类主要的活性物质。利用荧光探针DCFH-DA 装载细胞,可以检测细胞内ROS的含量。DCFH-DA是一种常用的ROS检测探针,自身没有荧光,能自由透过细胞膜,并被细胞内的酶类去乙醯基后形成DCFH,DCFH 依然没有荧光,但是它不能透过细胞膜。随后DCFH 可以被胞内活性氧类物质氧化为DCF,DCF能发出很强的荧光,其强度可间接反映细胞内活性氧的总体生成水平。
通过使用DCFH-DA 探针对等离子处理后的各组细胞进行标记,用荧光分光光度计和流式细胞仪检测其荧光的变化,可以反映出等离子体对细胞内ROS含量的影响。结果如图3.5.5 所示,等离子体处理后立刻对细胞内的ROS进行检测,各组之间没有明显的差异;而细胞继续培养24h后,细胞内的ROS含量随着等离子体处理时间的增加而明显增加,并在720s处理时达到最大值。与NO 的含量变化类似,960s处理的细胞内ROS 含量低于720s的,这可能是由于长时间处理引起的细胞死亡及细胞膜的破坏,使细胞内的物质向细胞外发生了渗漏而无法检测到ROS荧光造成的[13]。
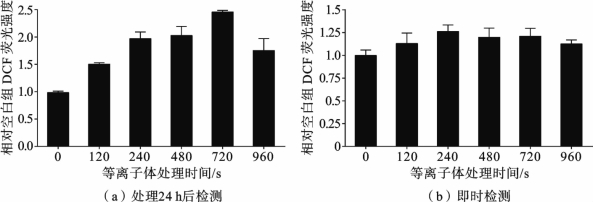
图3.5.5 等离子体处理对细胞内的ROS含量的影响[13]
图3.5.6中流式细胞术结果显示,等离子体处理240s、480s和720s后并继续培养24h,各组内DCF 阳性细胞比例分别为33.00%、78.81%和84.75%,显著高于无处理对照组(13.78%),进一步说明等离子体处理可以使细胞内积累大量的ROS。
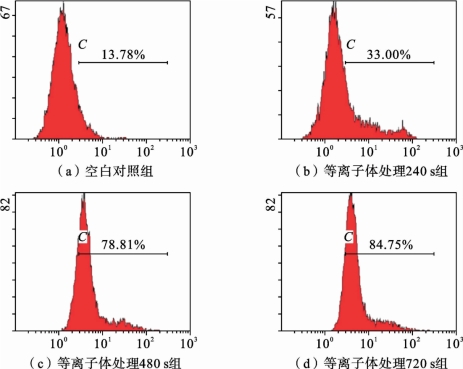
图3.5.6 DCFH-DA 探针标记后流式细胞术检测大气压非平衡等离子体射流处理对HepG2细胞内ROS水平的影响[14](https://www.xing528.com)
3.大气压非平衡等离子体射流对HepG2细胞内抗氧化水平的影响
细胞内ROS和RNS的积累意味着细胞内氧化压力的存在,而细胞内氧化/抗氧化水平的平衡对于细胞抵抗氧化/硝化压力是非常必要的。因此进一步评估等离子体处理后HepG2细胞内抗氧化防御系统的水平是十分必要的。细胞内的抗氧化防御系统主要由抗氧化酶和非酶抗氧化剂组成,如谷胱甘肽(glutathione,GSH),超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)和谷胱甘肽还原酶(glutathione reductase,GR)等。通过使用商业的检测试剂盒可以检测这些抗氧化酶的活性以及非酶抗氧化剂的含量,从而反应细胞内抗氧化防御系统的高低。
结果如图3.5.7(a)所示[14],GSH 主要通过自身与活性氧反应生成氧化型的GSSG 而清除活性氧自由基,是细胞抗氧化防御系统中一种重要的抗氧化剂。等离子体处理后HepG2 细胞内总GSH 含量有显著下降,特别是在720s等离子体处理组中,其GSH 含量明显下降,仅为对照组的13%。这一结果表明,等离子体处理后HepG2细胞内的谷胱甘肽防御系统水平显著下降,等离子体处理可能会造成细胞内谷胱甘肽防御系统的崩溃。
SOD 主要催化超氧化物阴离子的歧化反应,是细胞抗氧化防御系统中重要的抗氧化酶类。对SOD 的检测结果如图3.5.7(b)所示,与无处理的对照组相比,在相对低剂量等离子体处理组(240s),SOD 酶活力有一定的提高,表明相对低剂量的等离子体处理(240s)使细胞内遭受氧化压力,由于氧化应激细胞内的SOD 酶活力上调以清除细胞内的活性粒子从而避免氧化损伤;然而当HepG2细胞遭受长时间的等离子体处理时(480s和720s),细胞内的SOD 酶活力下降为对照组的75%和37%左右,此时细胞内的氧化压力超出了抗氧化剂的清除能力,细胞内的抗氧化防御系统妥协,表现为SOD 酶活力下降。
细胞内过氧化氢的酶活力如图3.5.7(c)所示,240s、480s和720s等离子体处理中,过氧化氢酶的酶活力分别为对照组的80%、30%和16.7%。过氧化氢酶酶活力下降,提示细胞内抗氧化防御水平下降。
上述结果表明,等离子体处理后,HepG2细胞内的抗氧化防御水平有显著下降。高水平ROS和RNS的积累以及显著下降的抗氧化防御水平意味着HepG2细胞内氧化与抗氧化平衡被破坏,这可能是等离子体诱导HepG2细胞凋亡的主要原因。
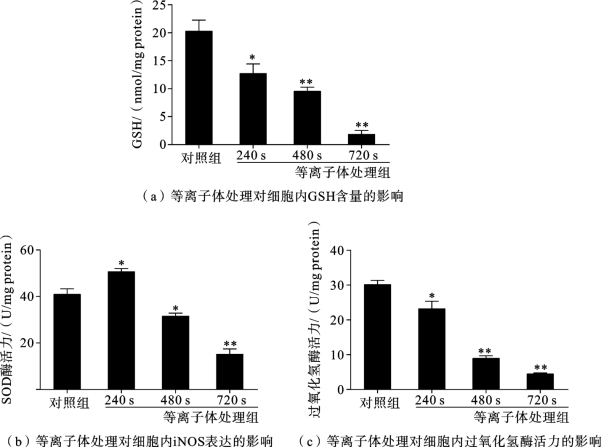
图3.5.7 等离子体处理对HepG2细胞内抗氧化水平的影响[14]
*P<0.05, **P<0.01;n=3
4.大气压非平衡等离子体射流处理HepG2细胞内硝化/氧化损伤评估
研究表明,机体在遭受各种有害刺激时,体内高反应活性物质(如活性氧自由基和活性氮自由基)过多积累,氧化程度超出机体抗氧化系统的清除能力,氧化系统和抗氧化系统失衡。这些活性氮簇与活性氧具有极强的细胞毒性,可导致生物有机体遭受损伤,与细胞凋亡存在着十分密切的关系。细胞内的蛋白质表达量很高,往往是ROS和RNS攻击的主要靶点。
细胞内大量的RNS可以造成细胞内蛋白质酪氨酸残基的硝基化,继而发生蛋白质功能改变或失活,而这种变化是不可逆的,因此可以对细胞造成不可逆的硝化损伤。因此,蛋白质硝基酪氨酸水平成为人们评价细胞硝化损伤的主要指标。等离子体处理后HepG2 细胞内硝基酪氨酸的水平可以通过WesternBlot方法检测。结果如图3.5.8所示,在对照组中,蛋白质硝基酪氨酸水平较低;然而,经等离子体处理后,硝基酪氨酸水平显著上调,表现为硝基酪氨酸表位条带的加深,特别是分子量为26~30kDa和42~44kDa处的蛋白质,蛋白质硝基化尤为显著。这个结果表明,HepG2细胞经等离子体处理并培养24h后,细胞内发生了硝化损伤,这可能是造成HepG2细胞凋亡的重要原因或重要原因之一。
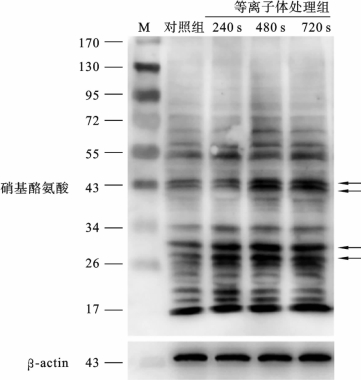
图3.5.8 等离子体处理后HepG2细胞内蛋白质硝基化水平评估[14]
在细胞内,蛋白质肽链通常会受到ROS攻击而断裂,从而形成羰基。因此,人们通常通过评估蛋白质羰基水平来评测细胞是否遭受氧化损伤。蛋白质羟基化水平检测已有成熟的检测试剂盒可以使用。所得结果如图3.5.9所示,细胞经等离子体处理后,蛋白质羰基水平均有提高,特别是720s等离子体处理组中,其蛋白质羰基含量达到了处理组的2倍之多。
5.N-乙酰半胱氨酸(NAC)拮抗等离子体对HepG2细胞的凋亡作用
综上所述,等离子体处理造成HepG2细胞内氧化与抗氧化的失衡,这种失衡最终造成了HepG2细胞内硝化和氧化损伤的发生,进而影响细胞的功能。这是否是等离子体诱导HepG2细胞凋亡的直接原因呢? 为了验证ROS和RNS 是等离子体诱导HepG2 细胞凋亡的关键作用因子,用抗氧化剂(NAC)预处理HepG2细胞后,进行等离子体处理,Annexin V-FITC/PI双染法检测等离子体诱导的HepG2 细胞凋亡率。所得结果如图3.5.10 和图3.5.11 所示,NAC几乎完全拮抗了等离子体诱导的HepG2细胞凋亡。在无NAC 预处理组中,等离子体处理240s和480s可以分别诱导18.3%和22.9% 的细胞凋亡。然而NAC 预处理几乎完全消除了这种作用,等离子体处理240s和480s的细胞凋亡率仅为2.3%和2.9%。这说明,NAC 预处理明显拮抗了等离子体诱导的HepG2细胞凋亡,其作用机理与NAC 阻断自由基的产生及细胞内氧化/硝化应激有关。因此,ROS和RNS是等离子体诱导HepG2细胞凋亡的关键作用因子。
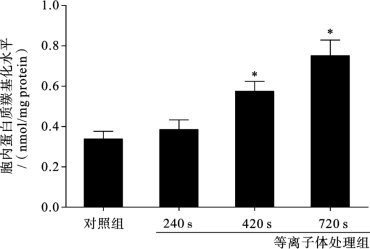
图3.5.9 等离子体处理后HepG2细胞内蛋白质羰基化水平检测[14]
*P<0.05,** P<0.01;n=3
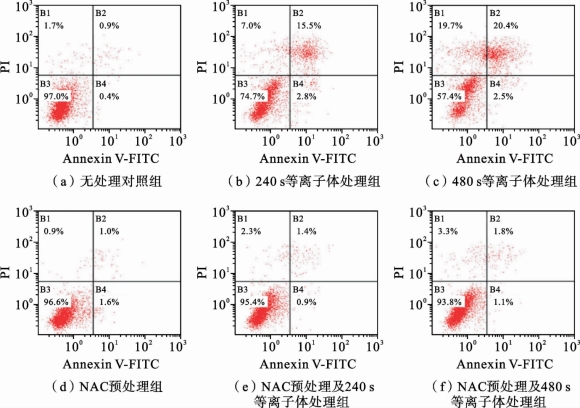
图3.5.10 抗氧化剂NAC拮抗等离子体诱导的HepG2细胞凋亡[14]
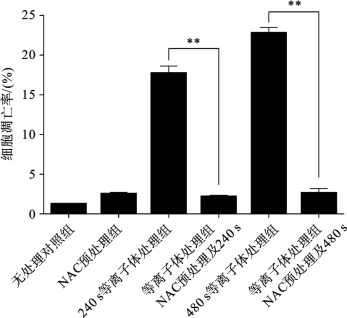
图3.5.11 抗氧化剂NAC对等离子体诱导的HepG2细胞凋亡率的影响[14]
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




