1.PAO 的制备
该方案采用N-APPJ直接处理橄榄油的方式,所用的等离子体装置与2.2.1节的相同。该等离子体由交流电源驱动,电压峰-峰值为24kV,频率为10kHz。所用工作气体为He+10%O2,气体流量为0.5L/min。图2.6.1(a)给出了N-APPJ处理橄榄油的示意图。处理时,首先在反应容器中加入100g橄榄油,然后用N-APPJ对橄榄油进行1~7h的处理,并且每隔半个小时测量一次油温。图2.6.1(b)给出了气流对橄榄油作用的瞬态照片。从中可以看出,由于气流的喷射作用,油中会形成不稳定的空腔(偶尔会出现破裂以及形成气泡等现象),对比图2.6.1(c)可知,在空腔底部发生了沿面放电现象,这是空腔内表面的电荷积累产生的较强的径向电场所致[83~84]。处理完毕,将PAO冷藏(2 ℃~8 ℃,避光)或者在室温下存储在透明的玻璃瓶中,以确定PAO 的保质期。图2.6.1(d)为未处理的橄榄油和处理完毕的活化油照片。
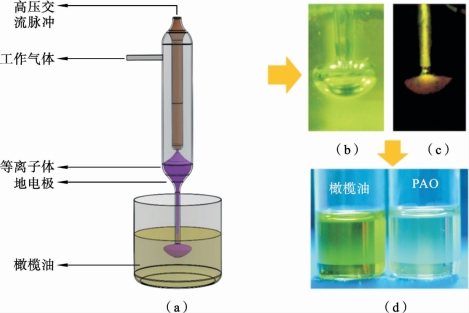
图2.6.1 N-APPJ处理橄榄油的装置和过程[80]
(a)N-APPJ处理橄榄油示意图;(b)气流在油内形成气腔的照片;(c)气腔内的等离子体照片;(d)未处理的生橄榄油和经N-APPJ处理完毕的透明PAO(经4h等离子体处理)
2.PAO 的特性分析
PAO 相关的主要参数包括过氧化值(PV)、碘值(IV)、酸值(AV)三类。过氧化值是等离子体处理后油中形成的过氧化物总量[85],以过氧化物的毫摩尔数表示。碘值是指碘与油中的 C= C双键反应的量,它表示油的不饱和度。碘值常用韦氏法(Wijs)进行测定。酸值是指油中游离脂肪酸的含量,单位为mg。
图2.6.2 给出了PAO 的过氧化值、碘值和酸值的检测结果。其中,图2.6.2(a)为PAO 的过氧化值随处理时间的变化曲线。经过7h的N-APPJ处理,过氧化值由4meq/kg上升到210meq/kg。而采用传统的臭氧油处理相同的时间过氧化值只能达到28meq/kg[85],这说明等离子体直接处理的活化油当中生成了较多的过氧化物。由于 C= C 双键的能量仅为6.36eV,而等离子体中有部分电子能量较高,甚至高于10eV[86],并且亚稳态分子或离子的能级也非常高,因此沿空腔内表面放电产生的高能粒子可能会破坏等离子体与油交界面处的 C= C双键,而O 原子则与C—H 键直接反应形成H2O2和羧酸,这比臭氧油中通过溶解O3来与 C= C 双键反应要快得多。同时,由流注放电引起的对流也促进了活性物质在PAO 中的传输。

图2.6.2 PAO、SPAO 和传统臭氧油之间的对比分析[80]
为了进一步了解PAO 的性能,下面将PAO 与通过臭氧发生器产生的臭氧化油比较[85]。臭氧发生器的主要参数:O3产量为200 mg/h,空气流量为2L/min。气流中的O3密度为2.09×1016cm-3,这比本研究中使用的N-APPJ产生的O3密度要高10倍。产生的臭氧通过气流进入油中,其中溶解的臭氧会与 C= C双键反应,然而,臭氧在橄榄油中的溶解极为有限。虽然臭氧在橄榄油中的溶解度未知,但已知氧气在橄榄油中的溶解度仅为同等条件下在水中溶解度的0.026%[87],因此,可以预估臭氧在油中的溶解度极小。此外,由于等离子体呈电中性,因此,其离子密度与电子密度相同。而亚稳态原子和分子(如![]() 和
和![]() )的密度要比电子的密度高出1到2个数量级,因此,等离子体与橄榄油交界面处具有高密度的电子、离子和亚稳态分子等高能粒子。表面放电的O 原子密度为6×1016cm-3,是臭氧油中通入臭氧密度的3 倍。C =C双键被高能粒子解离,然后O 原子可以与单一氢键重新结合形成过氧化氢和羧酸。后面的FTIR 测量也表明,PAO 中消耗的 C= C 双键要比臭氧油中消耗的更多,因此,等离子体活化油的过氧化值要远高于臭氧化油。
)的密度要比电子的密度高出1到2个数量级,因此,等离子体与橄榄油交界面处具有高密度的电子、离子和亚稳态分子等高能粒子。表面放电的O 原子密度为6×1016cm-3,是臭氧油中通入臭氧密度的3 倍。C =C双键被高能粒子解离,然后O 原子可以与单一氢键重新结合形成过氧化氢和羧酸。后面的FTIR 测量也表明,PAO 中消耗的 C= C 双键要比臭氧油中消耗的更多,因此,等离子体活化油的过氧化值要远高于臭氧化油。
图2.6.2(b)展示了PAO 的碘值在处理7h后从81g/100g下降到65g/100g,进一步表明了等离子体通过消耗 C= C 双键形成活性粒子。图2.6.2(c)为PAO 的酸值随N-APPJ处理时间的变化。随着等离子体处理时间的增加,酸值也逐步增加。经过7h的N-APPJ处理,PAO 的酸值从0.45mg/g增加到2.6mg/g。N-APPJ处理7h的PAO 的酸值要比臭氧油高57%[85]。
与传统臭氧油相比,PAO 和SPAO(两种存储条件:第一种在2 ℃~8 ℃冷藏,避光;第二种在25 ℃~35 ℃存储,有光照。两种均保存三个月以上)具有更高的反应活性和稳定性。
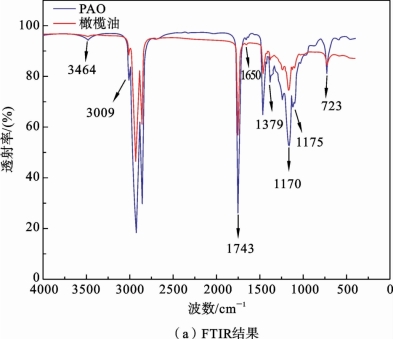
图2.6.3 PAO 和未处理的橄榄油的FTIR 和GC-MS扫描结果[80]
为了分析等离子体内部的活性粒子与橄榄油的结合情况,下面首先对PAO和橄榄油原液的FTIR做比较。PAO 和橄榄油的红外光谱如图2.6.3(a)所示。在红外光谱中,橄榄油中不饱和脂肪酸的C—H 振动(约723cm-1)、C = C展宽(约1650cm-1)、C = O 展宽(约1743cm-1)和C—H 展宽(约3009cm-1),以及氧化C—O 展宽(约1170cm-1)和C—H 展宽(约3009cm-1)用于评估PAO 的活性[88~90]。
续图2.6.3
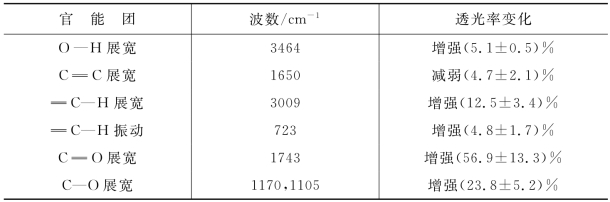
表2.6.1列出了PAO 和未处理的橄榄油的FTIR 变化情况。由表可知,C =C展宽(约1650cm-1)透光率下降,而C—H 展宽(约3009cm-1)、C—O展宽(约1105cm-1)、C =O 展宽(约1743cm-1)、O—H 展宽(约3464cm-1)和C—H 振动(约723cm-1)[89]的透光率则在等离子体处理后显著增加。实际上,植物油中最重要的不饱和脂肪酸是亚麻酸(具有三个双键)、亚油酸(具有两个双键)和油酸(具有单个双键)。之前的测量表明,臭氧化过程可以减少这些不饱和脂肪酸[88]。而通过N-APPJ处理橄榄油的过程明显加强了射流与橄榄油交界面处放电所引起的不饱和脂肪酸的氧化。C = C 展宽减少,C—H、C—O、O—H 展宽增加表明N-APPJ处理会导致 C= C 双键的裂解和氧化,这是PAO 产生的主要机制,等离子体中的活性氧粒子还会进一步转化为羧酸和H2O2等活性成分。
表2.6.1 等离子体活化油(4h)和橄榄油的FTIR 对比结果[80]
通过将PAO与臭氧油的FTIR 进行对比可以揭示出这两种活化油的氧化机理之间的差异。臭氧油和橄榄油中对应于 C= C 伸缩振动模式(约1650 cm-1)的透光率差异可以忽略不计[88]。然而,等离子体活化油中对应于 C= C伸缩振动模式(约1650cm-1)的透光率明显更高,这表明在等离子体与油交界面处的高能粒子会消耗更多的 C= C 双键。此外,臭氧油中1743cm-1对应的 C= O 键位透光率变化不大[88],而等离子体活化油1743cm-1对应 C= O键位的透光率从原始橄榄油的60%降低到等离子体活化油的22%,这不仅表明更多的羧酸在等离子体活化油中产生,并且57%的透光率的增加也说明了与之对应的羧酸含量更高,这个结果与前面分析的PAO 中的酸值比臭氧油要高的结论是相符的。
图2.6.3(b)的GC-MS测量结果表明,N-APPJ处理显著降低了油酸(保留时间为11.83min,不饱和脂肪酸)的相对强度,硬脂酸(保留时间为11.62 min,不饱和脂肪酸)的相对强度也略有降低。这个结果与通过傅里叶红外光谱(FTIR)测量的 C= C 展宽信号降低的结果是一致的。等离子体处理后棕榈酸(保留时间为7.09min,饱和脂肪酸)的相对强度降低,这表明等离子体的强解离和氧化能力也会影响橄榄油的C—C单键。
1H-NMR 谱图如图2.6.4所示,其中1为橄榄油,2为PAO,3为保存三个月的PAO(SPAO)。氢谱中显示了氧化信号的几个特征区域,特别是δ=5.11(对应臭氧化物的多重态)处和δ=9.7(醛基质子的三重态)处对应的信号。除此之外,氢谱中δ=5.13处的质子共振信号与碳谱中δ=104处的碳共振信号相关,它们属于相应的质子和 C= C双键,这些信号对应于活性氧原子或臭氧氧化的粒子,以及橄榄油中亚油酸的 C= C双键[90]。
橄榄油经等离子体处理后,δ=130、δ=129和δ=128处的 C= C 双键显著减少,这与之前测得的活化油碘值下降和傅里叶红外光谱的 C= C 双键吸收信号降低的结果是相符的。图2.6.4进一步给出了δ=4.30处双峰信号和δ=2.28处三重峰信号所对应的亚甲基氢,以及δ=5.32处的多重峰所对应的甘油C—H 单键。上述信号在橄榄油、PAO 和SPAO 的之间的区别很小,这表明并非所有双键都与原子氧、臭氧或者等离子体中的其他激发态粒子发生反应[90]。
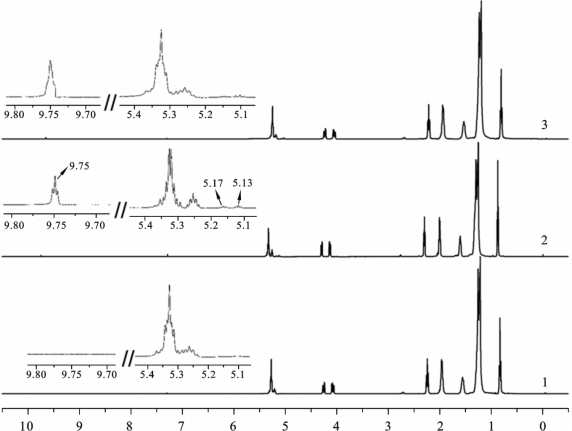
图2.6.4 1H-NMR 证实了PAO 的稳定性和独特的活性产生机制[80](https://www.xing528.com)
1:未处理的橄榄油;2:PAO;3:SPAO(2 ℃~8 ℃,避光,药物的通常保存条件)
与臭氧油的1H-NMR 谱中δ=5.11处信号强度明显增加不同[91],PAO 中δ=5.11处的信号几乎不变。与臭氧油中δ=104的信号强度增加相比,PAO的13C-NMR 中δ=104处信号强度的增加幅度也很小[92]。在氢谱中δ=5.11处和碳谱中δ=104处的两种信号均对应于1,2,4-三氧环戊烷的官能基团[92]。因此可以得出结论,相比臭氧油,等离子体处理的活化油中的中间产物1,2,4-三氧环戊烷的浓度很小。
与臭氧油的臭氧化过程不同,等离子体主要是通过内部的高能粒子来消耗 C= C双键,这已通过FTIR 证明,因而造成了1,2,4-三氧环戊烷的浓度差异。图2.6.6进一步给出了臭氧油和活化油中活性粒子生成的不同机制,即在活化油中,通过 C= C双键的裂解作用以及活性氧原子的氧化作用,使得等离子体活化油中产生羧酸和H2O2。在等离子体活化油的机制下,臭氧氧化C =C双键以形成1,2,4-三氧环戊烯这一过程的作用是很小的。
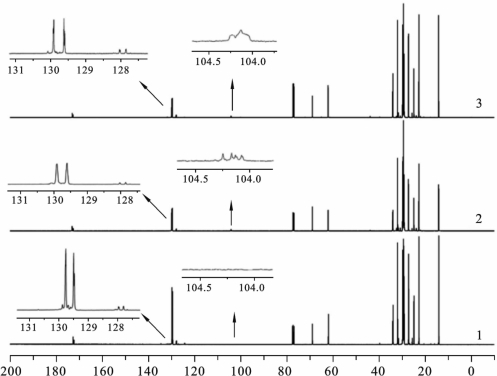
图2.6.5 13C-NMR 测量结果[80]
1:未处理的橄榄油;2:PAO;3:SPAO(2 ℃~8 ℃,避光,药物的通常保存条件)
下面进一步比较了存储3个月(2 ℃~8 ℃,避光,药物的通常保存条件)的SPAO(保存3个月以上的PAO)的1H-NMR 和13C-NMR,如图2.6.4和图2.6.5所示,发现其与PAO 的差异可以忽略不计。这与前面过氧化值、碘值和酸值的比较结果是一致的。这些结论表明等离子体活化油在闭光冷藏的情况下能够至少保存3个月。
实验还考察了比较苛刻条件下(25 ℃~35 ℃条件下,阳光照射3个月后)PAO 存储后的活性情况。如图2.6.2的蓝色三角形表示,可以发现,该存储条件下SPAO 相比刚处理得到的PAO,其过氧化值降低了22.7%,碘值增加了3%,酸值增加了16.4%。活化油的过氧化值,作为其最关键的参数,远高于臭氧油。由于绝大部分药物在阴凉干燥处,以及冷藏的条件下都可以拥有更好的存储效果,而已有报道臭氧氧化的橄榄油在-10 ℃至8 ℃的温度范围内可以稳定存储至少1年[93],因此,等离子体活化油的保质期保守估计应当与臭氧油相近,即1年以上。
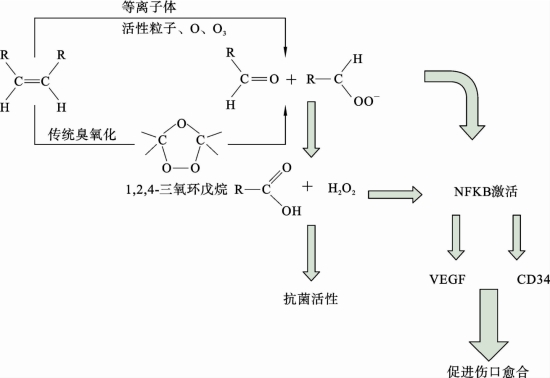
图2.6.6 等离子体活化油和臭氧油的活性粒子产生机制[80]
如前所述,等离子体活化水的保质期则非常有限,这主要是由于水中的H2O2自然降解。即便在磷酸盐缓冲盐的辅助下,等离子体活化水也只能在-25 ℃的温度下保存3天[94]。与PAW 相比,PAO 中的氢过氧化物和二烷基过氧化物显著减缓了H2O2的降解,这可能是PAO 保质期更长的原因。
3.PAO 的杀菌效果
由于伤口的愈合过程中会受到大肠杆菌、MRSA 以及铜绿假单胞菌等引起的皮肤感染的影响。因此,这里研究了PAO 对大肠杆菌和MRSA 的抗菌活性。培养结果表明,PAO 和SPAO 以及橄榄油对大肠杆菌可以产生直径11~29mm 的抑菌环,如图2.6.7所示。其中图2.6.7(c)进一步表明,橄榄油下方仍有细菌菌落,说明橄榄油自身对灭菌的影响很小。而PAO 的抑菌面积是单纯橄榄油处理的9倍,说明PAO 具有较高的杀菌效率。储存3个月后的SPAO 也保持了较强的灭菌能力(图2.6.7(b)、(f))。图2.6.7(e)~(h)表明PAO 和SPAO 也能有效地杀死MRSA。由于MRSA 的接种浓度(106 CFU/mL)比大肠杆菌(104CFU/mL)要高2个数量级,因此PAO 和SPAO 处理的MRSA 的抑菌环直径要小于大肠杆菌(比较图2.6.7(a)、(b)和图2.6.7(e)、(f))。

图2.6.7 PAO、SPAO 及橄榄油处理大肠杆菌和MRSA 的结果[80]
(a)、(e)为PAO;(b)、(f)为SPAO(2 ℃~8 ℃,闭光三个月以上);(c)、(g)为橄榄油;(d)、(h)为对照组;(a)~(d)为大肠杆菌,(e)~(h)为MRSA
基于上述实验结果,可以得出影响等离子体活化油杀菌效率的两个关键因素。第一个是等离子体活化油中的羧酸,它可以导致细胞膜破裂,抑制必需的代谢反应,并使细胞内pH 稳态失衡[95]。除了实验中使用的非致病性大肠杆菌外,羧酸还可以杀死其他几种细菌[96]。第二个因素是H2O2。H2O2由正负离子、氢过氧化物和二烷基过氧化物等产生,并且其又可以产生更多具有生物活性的和细胞毒性的含氧活性粒子,例如羟基自由基,它是一种强氧化剂并且可以引发诸多生物大分子的氧化[97]。
4.PAO 的伤口愈合效果
下面采用经过4hN-APPJ处理后的PAO 对伤口进行处理,所得结果如图2.6.8所示。可以得出,PAO 组创面愈合时间明显短于对照组和未经NAPPJ处理的橄榄油组。至第7天时,与橄榄油组和对照组相比,PAO 组的伤口愈合情况已有显著改善。至第14天,PAO 组创面愈合,对照组和橄榄油组创面愈合率分别为79%和83%。对照组伤口在第19 天才完全闭合。对比SPAO 可知,存储3个月后的活化油仍然具有加速伤口愈合的能力。具体地,SPAO 处理伤口愈合率在第3天为35%,第7天为60%,第10天为86%,第14天为95%。这非常接近等离子体立即处理后的活化油伤口愈合率。
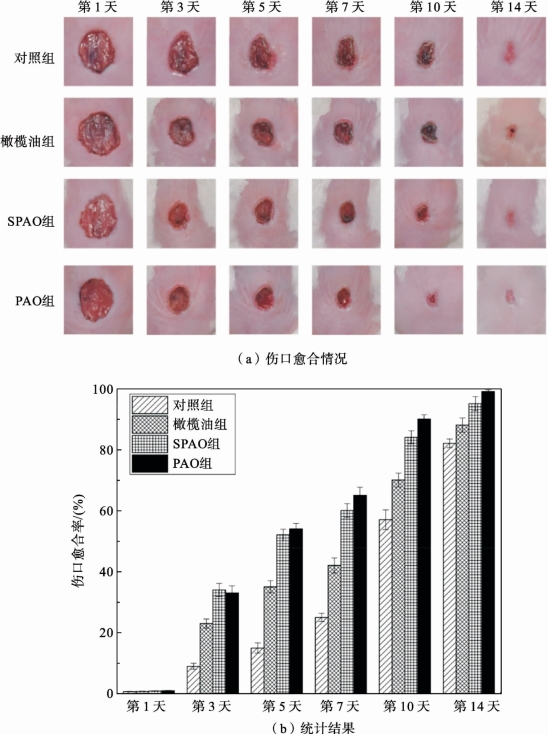
图2.6.8 PAO、SPAO、橄榄油处理伤口愈合照片及统计结果[80]
进一步对PAO 处理后的小鼠皮肤进行了免疫组化分析。成纤维细胞可以影响细胞周期蛋白CD34(促进胶原合成和基质再生的诱导)和血管内皮生长因子VEGF 的产生,因而其在皮肤伤口的上皮化中起到很关键的作用。CD34和VEGF都是由转录因子NFkB 调节的基因,NFkB 可以被氧化剂激活[98]。因此,在伤口局部释放过氧化物或其介质可以激活伤口中的NFkB 转录因子,促进其向细胞核的易位,以及在伤口愈合中发挥关键作用的CD34和VEGF的转录。
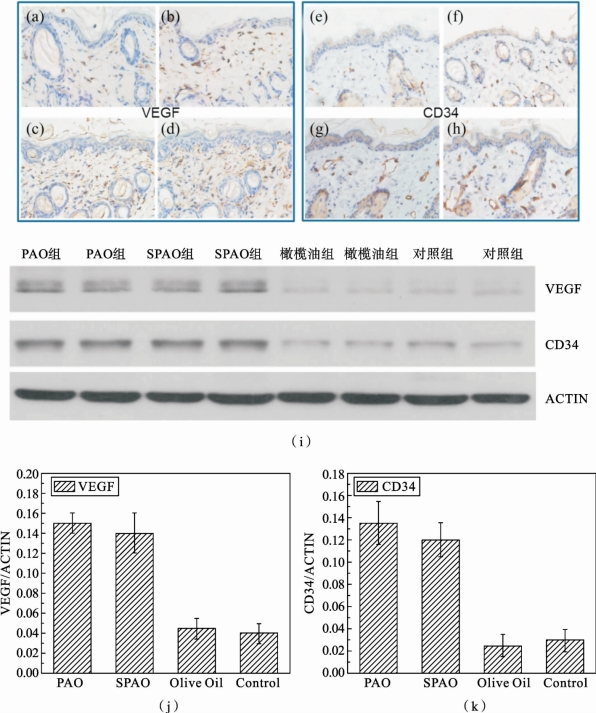
图2.6.9 小鼠血管内皮生长因子(VEGF)和细胞周期蛋白(CD34)表达情况[80]
(a)空白对照组VEGF表达;(b)橄榄油组VEGF 表达;(c)PAO 组VEGF 表达;(d)SPAO 组VEGF表达;(e)空白对照组CD34表达;(f)橄榄油组CD34表达;(g)PAO 组CD34表达;(h)SPAO CD34表达;(i)WesternBlot分析结果;(j)、(k)VEGF和CD34累积光密度值比较[80]
CD34和VEGF的免疫细胞化学反应强度如图2.6.9所示。根据处理后第7天组织检查,各组CD34和VEGF 免疫组化染色均为阳性。从图2.6.9中可以直观地看出VEGF与CD34在等离子体活化油组的累积光密度值要显著高于对照组和橄榄油组。其中,VEGF 中对照组为420±100,橄榄油组为530±110,SPAO 组为1550±200,PAO 组为1650±200;CD34 中对照组为400±100,橄榄油组为370±80,SPAO 组为1110±120,PAO 组为1220±110。VEGF与CD34在皮下组织的阳性表达要更多,也就说明小鼠皮肤伤口微血管数量增殖更多,恢复速率更快。此外,WesternBlot分析(图2.6.9(i)~(k))进一步表明,PAO 和SPAO 组的VEGF与CD34蛋白表达量明显比橄榄油和对照组的更高。与相关臭氧油的研究结果对比,臭氧油组和对照组累计光密度值的比值VEGF 分别为2.78和2.5[99],而本研究中对应的比值为4.15和3.04。因此,等离子体活化油相比臭氧油能够促进更多生长因子的释放,而这也归因于等离子体活化油中更高的过氧化物含量。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




