理想气体的等压、等体、等温三个等值过程,以及绝热过程都是理想的过程,实际上它们都是较难实现的.实际过程往往与这四个理想过程有所偏离,其过程方程并不像四个理想过程的相关方程那样简单.
把绝热过程方程式(8.20)推广为下面的方程

其中n 是对应于某一特定过程的常数,可以取任意实数.这个方程称为理想气体的多方过程方程,n 称为多方指数.由式(8.22)可以看出:
(1)当n=γ 时,式(8.22a)为理想气体绝热过程方程;
(2)当n=1 时,式(8.22a)为理想气体等温过程方程;
(3)当n=0 时,式(8.22a)描述的就是理想气体的等压过程;
(4)如把式(8.22a)写成p1/nV=常数,则当n→∞时,其描述的就是理想气体的等体过程.
理想气体在多方过程中做的功为

内能的增量仍由计算内能的普适公式dE=CV,mdT 进行积分计算,这是因为理想气体内能的改变仅与其始末状态有关,与过程无关的缘故.而在多方过程中所吸收的热量可由热力学第一定律进行计算.
例8.1 一气缸中储有氮气,质量为1.25 kg.在标准大气压下缓慢地加热,使温度升高1 K.试求气体膨胀时所做的功A、气体内能的增量ΔE 以及气体所吸收的热量Qp(活塞的质量以及它与气缸壁的摩擦均可略去).
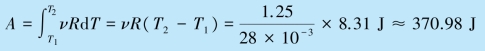
解 由题意知过程是等压的,所以由定体摩尔热容的定义可知内能的变化可表示为
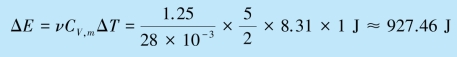
根据热力学第一定律,气体在这一过程中所吸收的热量为
![]()
例8.2 如图8.3 所示,有1 mo1 的氢气最初的压强为1.013×105 Pa、温度为20 ℃,求在下列过程中,把氢气压缩为原来体积的1/10 需要做的功:(1)等温过程;(2)绝热过程;(3)经这两过程后,气体的压强各为多少?
解 (1)对于等温过程,由式(8.17)可得氢气由状态A 等温压缩到状态B,做的功为


图8.3 例8.2 用图
负号表示气体对外界做负功,即外界对气体做功.
(2)因为氢气是双原子气体,故其比热容比γ=1.4,所以对于绝热过程AC,由式(8.20b),可求得状态C 的温度为TC
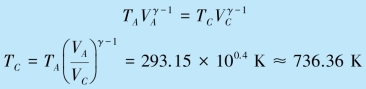
由式(8.21)可知,氢气由状态A 绝热压缩到状态C 做的功为(https://www.xing528.com)

式中负号表示外界对气体做功.
(3)状态B 和C 的压强.对等温过程AB,由pAVA=pBVB 可得

对绝热过程,由![]() 可得
可得

*例8.3 一定量的双原子分子理想气体,经pV2=C(常量)的准静态过程,从状态(p1,V1)变到体积为V2 的状态,试求气体在该过程中对外所做的功A,内能增量ΔE,吸入的热量Q 和摩尔热容C.
解 将过程方程pV2=C 改写成
![]()
可得末态气体的压强
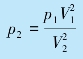
以及压强p 随体积V 变化的函数关系

将上式代入功的公式,可得气体在该过程中对外所做的功
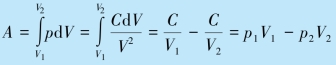
其中p2 已经在前面计算出了.双原子理想气体分子的自由度i= 5,故内能增量
![]()
由热力学第一定律,可得气体吸入的热量
![]()
为了求出该过程的摩尔热容,可由p1V1=νRT1,p2V2=νRT2 得到过程中的温度变化为
![]()
则过程的摩尔热容为:

摩尔热容也可以用基本公式计算,比如
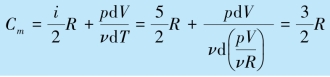
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




