【摘要】:在等压过程中,压强p 保持不变,则其过程方程为等压过程中系统的体积和温度呈正比关系.等压过程曲线在p-V图上是一条平行于V 轴的线段.根据热力学第一定律,对有限的等压过程应有在等压过程中理想气体吸收的热量一部分用来增加气体的内能,另一部分转化为气体对外界做的功;或者是外界对系统做的功和系统减少的内能全部以热量的形式放出.这就是等压过程系统能量转化的特点.设有1 mol 的理想气体,在等压过程中吸收

在等压过程中,压强p 保持不变,则其过程方程为等压过程中系统的体积和温度呈正比关系.等压过程曲线在p-V图上是一条平行于V 轴的线段.
根据热力学第一定律,对有限的等压过程应有
![]()
在等压过程中理想气体吸收的热量一部分用来增加气体的内能,另一部分转化为气体对外界做的功;或者是外界对系统做的功和系统减少的内能全部以热量的形式放出.这就是等压过程系统能量转化的特点.
设有1 mol 的理想气体,在等压过程中吸收热量ΔQp,同时温度升高ΔT,则气体的定压摩尔热容为
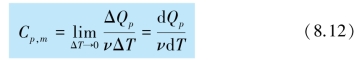
定压摩尔热容的单位为焦每摩尔开,符号为J/(mol·K).定压摩尔热容Cp,m为常数的1 mol 理想气体在有限等压过程中吸收的热量为
![]()
利用热力学第一定律式(8.5)和式(8.9)可得(https://www.xing528.com)
![]()
根据1 mol 理想气体物态方程pV=RT,对此式两边取微分并考虑到等压过程中dp=0,可得pdV=RdT,将此结果带入上式,有
![]()
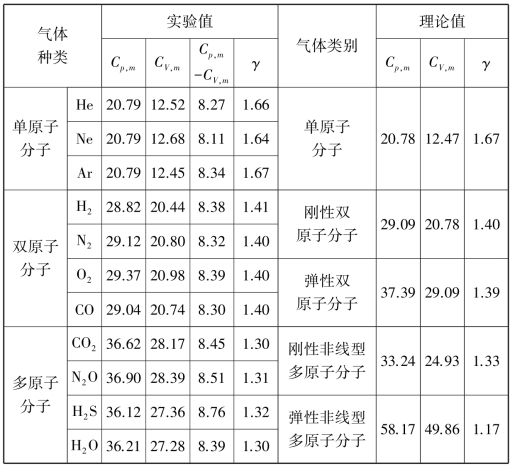
式(8.14)就是理想气体定压摩尔热容和定体摩尔热容之间的关系,称为迈耶公式.它表明,理想气体的定压摩尔热容与定体摩尔热容之差为摩尔气体常量R,也就是说,在等压过程中,1 mol 理想气体温度升高1 K 时,要比等体过程多吸收8.31 J 热量,以用于对外做功.从表8.1 可以看出,在通常温度及压强下的气体(可视为理想气体),尽管它们的定压摩尔热容Cp,m和定体摩尔热容CV,m的实验值与理论值并不完全相同,两者之差与普适气体常量R 的值非常接近.
在实际应用中,常用比热容比γ 表示Cp,m与CV,m的比值

表8.1 几种气体的Cp,m、CV,m和γ 的理论值和实验值
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




