与愈伤组织基因表达丰度相比,对各EC中差异表达基因进行韦恩分布统计分析,其结果表明各样品中共表达的差异表达基因数量为4 488个;1.5 mg/L PIC继代的EC中特异性表达的基因数量为2 835个;1.0 mg/L PIC继代的EC中特异性表达的基因数量为1 000个;2.0 mg/L PIC继代的EC中特异性表达的基因数量为608个;1.0与1.5 mg/L PIC继代的EC间共表达基因数量为1 427个;2.0与1.5 mg/L PIC继代的EC间共表达基因数量为736个;2.0与1.0 mg/L PIC继代的EC间共表达基因数量为485个(见图7-28)。

图7-25 2.0与1.5 mg/L PIC继代的胚性愈伤组织间上调表达基因细胞组分GO功能显著性富集分析

图7-26 2.0与1.5 mg/L PIC继代的胚性愈伤组织间下调表达基因细胞组分GO功能显著性富集分析
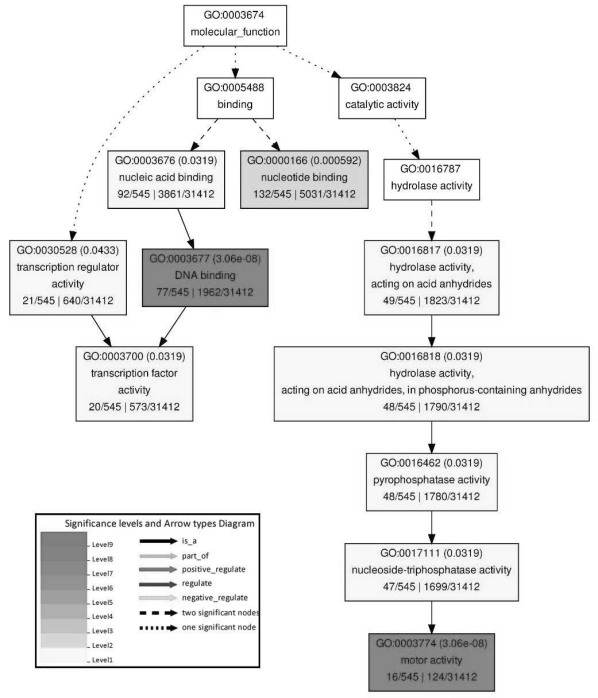
图7-27 2.0与1.5 mg/L PIC继代的胚性愈伤组织间下调表达基因分子功能GO功能显著性富集分析

图7-28 百子莲愈伤组织与胚性愈伤组织差异表达基因韦恩分布图
为了进一步了解百子莲EC中的4 488个共表达基因所调控的生物学过程,对这些基因进行了Page Man功能显著性注释分析。如图7-29所示,与百子莲愈伤组织相比所有EC中增强表达的生物学过程包含:胼胝质代谢(callose)、蜡质(WAX)、生长素信号转导(auxin signal transduction)、乙烯信号转录因子(AP2/ERBBP)、染色质结构与组蛋白修饰(chromatin structure,histone)及蛋白泛素化修饰(ubiquitin E3)。生长素的信号转导通常需要泛素化途径降解生长素信号的负转录调控因子AUX/IAA,因此蛋白泛素化修饰(ubiquitin E3)与生长素信号转导(auxin signal transduction)过程同时上调表达,很可能是泛素化过程参与调控了百子莲的生长素信号转导过程。而减弱的生物学过程有:光合(PS)、糖代谢(CHO metabolism)、细胞壁(cell wall)、脂类代谢(lipid metabolism)、次生代谢(secondary metabolism)、氨基酸代谢(amino acid metabolism)、激素代谢(hormone metabolism)、胁迫(stress)、氧化还原(redox)、外源性化学物质生物降解(biodegradation of xenobiotics)、蛋白(protein)和运输(transport)。这些生物过程的变化趋势说明百子莲从愈伤组织发育转变为胚性愈伤组织的过程中,生长素信号与乙烯信号增强,染色质结构与表观遗传修饰调控作用明显增强,细胞壁结构与附属结构发生重要的变化,物质能量代谢与次生代谢及能量运输过程减弱,整个过程中还伴随着氧化还原反应与胁迫刺激响应。

图7-29 百子莲愈伤组织与胚性愈伤组织共表达基因生物学功能PageMan可视化注释分析
每行代表单独的生物过程,红色代表上调,绿色为下调,颜色亮度表示差异程度(见标尺)
根据生物调控过程分类,发现在激素代谢、细胞过程、转录因子与DNA修复相关基因在所有样品中的表达情况存在较大的差异(见图7-30)。①在各样品激素代谢相关基因的韦恩图中,EC中特异性表达的基因数量为11,其功能上主要包括脱落酸、生长素、油菜素甾醇、细胞分裂素、乙烯、赤霉素、茉莉酮酸酯(见表7-2)。愈伤组织中特异性表达的基因有16个,这些基因在功能上包含生长素、脱落酸、油菜素甾醇、细胞分裂素、乙烯、赤霉素、茉莉酮酸酯(见表7-3)。②细胞过程相关基因中,在EC中特异性表达的基因有15个,在愈伤组织中特异性表达的基因有7个[见图7-30(b)]。③转录因子在EC中特异性表达的有35个[见图7-30(c)],主要包括b HLH、C2H2、GARP、HB、MYB、WRKY、ARF家族(见表7-4),在愈伤组织中特异性表达的有31个转录因子,主要有b HLH、C2H2、GRAS、HB、MYB与Aux/IAA家族(见表7-5)。④在DNA修复相关基因中,在愈伤组织中特异性表达的有1个基因,1.0、1.5与2.0 mg/L PIC继代的EC中特异性表达的基因数量分别有1、4与1个[见图7-30(d)]。
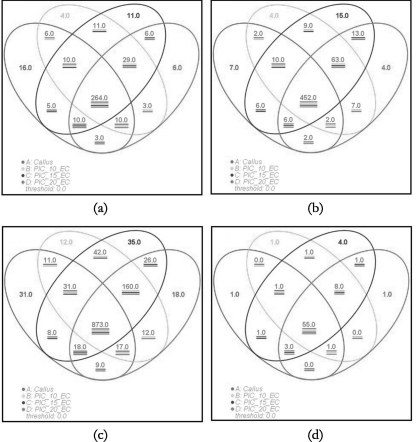
图7-30 百子莲愈伤组织与胚性愈伤组织部分调控过程上调表达基因韦恩分布图
(a)激素代谢 (b)细胞过程 (c)转录因子 (d)DNA修复
表7-2 1.5mg/LPIC继代的胚性愈伤组织特异性表达基因中激素相关基因列表

表7-3 百子莲愈伤组织特异性表达基因中激素相关基因列表

表7-4 1.5mg/LPIC继代的胚性愈伤组织特异性表达基因中转录因子列表

(续表)

表7-5 百子莲愈伤组织特异性表达基因中转录因子列表

(续表)

其中各样品中共表达的差异表达基因体现的是胚性愈伤组织与愈伤组织间的总体差异情况,而1.5 mg/L PIC继代的EC中特异性表达基因揭示了胚性愈伤组织在胚性诱导与保持过程中的关键调控基因。因此后续分析主要集中于所有样品的4 488个共表达基因与2 835个1.5 mg/L PIC继代的EC中特异性表达基因展开。
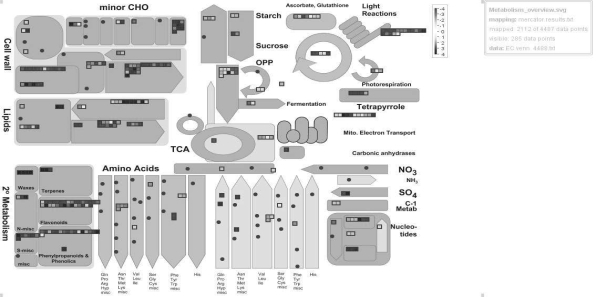
图7-31 百子莲愈伤组织与胚性愈伤组织4488个共表达差异基因代谢过程功能注释
每个方格代表单独的基因,红色代表下调,蓝色为上调,颜色亮度表示差异程度(见标尺)
对4 488个共表达基因进行生物学功能注释,如图7-31所示,在EC中的共表达基因中上调表达基因在代谢过程中主要参与调控片胼胝质(callulose)、棉籽糖(raf finose)、纤维素合成(cellulose synthesis)、蜡质(waxes)、色氨酸合成(tryptophan synthesis)、核苷酸代谢(nucleotides)、脂肪酸合成(FA synthesis)与糖酵解过程(glucolysis);下调表达基因在代谢过程中主要参与调控果胶甲酯酶(pectin esterases)、纤维素合成(cellulose synthesis)、果胶裂解酶(pectate lyase)、脂类代谢(lipid metabolism)、脂酶(lipase)、脂类降解(lipid degradation)、类黄酮代谢(flavonoids)、苯丙素代谢(phenylpropanoids)、光反应(light reactions)、卡尔文循环(calvin cycle)与光呼吸(photorespiration)。因此,在愈伤向胚性愈伤转变的过程中,细胞壁合成作用增强,细胞壁降解过程下降,脂肪酸合成增强,脂类代谢过程下降,光合作用过程减弱,淀粉蔗糖代谢下降。由于百子莲愈伤组织是在光培养条件下,而胚性愈伤组织在暗培养条件下培养,所以,光合作用过程下降很有可能由于材料的培养环境所引起。
4 488个共表达基因中,有大量的基因参与了转录调控、蛋白修饰与蛋白降解过程(见图7-32)。而在激素调控作用中,IAA、GA与ABA调控发生明显的改变,呈现上调表达调控;而乙烯、油菜素甾醇、细胞分裂素与茉莉酮酸酯信号调控途径发生明显的下调表达趋势。另外,在调控过程中钙信号、G蛋白与众多受体激酶也积极参与了愈伤组织的胚性转变过程(见图7-32)。

图7-32 百子莲愈伤组织与胚性愈伤组织4 488个共表达差异基因生物调控过程功能注释(https://www.xing528.com)
每个方格代表单独的基因,红色代表下调,蓝色为上调,颜色亮度表示差异程度(见标尺)
在细胞响应过程注释分析中,共表达基因主要参与调控细胞分裂(cell division)、细胞周期(cell cycle)与发育过程(development),且这些基因都呈现出上调表达(见图7-33)。在转录因子注释分析中,共表达基因中主要包含:GRAS,WRKY,Histone,HB,b HLH,AP2/EREBP(APETALA2/Ethylene-responsive element binding protein family),b ZIP,MYB,NAC,Chromatin remodeling与ARF(见图7-34)。这些家族主要在调控生长素信号、乙烯信号、分生组织、染色体结构等方面起到重要的作用。
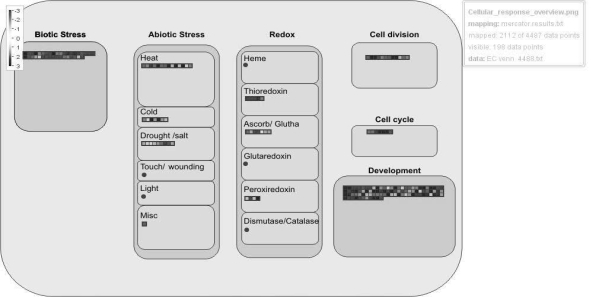
图7-33 百子莲愈伤组织与胚性愈伤组织4 488个共表达差异基因细胞响应过程功能注释
每个方格代表单独的基因,红色代表下调,蓝色为上调,颜色亮度表示差异程度(见标尺)

图7-34 百子莲愈伤组织与胚性愈伤组织4 488个共表达差异基因转录因子功能分类注释
每个方格代表单独的基因,红色代表下调,蓝色为上调,颜色亮度表示差异程度(见标尺)
1.5 mg/L PIC继代EC中特异性表达的2 835个基因在激素响应中主要参与生长素、脱落酸、油菜素甾醇与细胞分裂素信号转导过程;钙信号、G蛋白与受体激酶也表现出重要的调控作用;有较多的基因参与到转录因子、蛋白修饰与蛋白降解过程中(见图7-35)。在细胞响应功能注释中,较多的基因调控细胞分裂、细胞周期与发育过程,且基本呈现上调表达(见图7-36),说明1.5 mg/L PIC对EC在细胞分裂与增殖方面存在较好的调控作用。转录因子注释分析表明在2 835个特异性表达基因中,主要包括Histone、HB、b ZIP、MYB、Chromatin remodeling、C2H2与AUX/IAA(见图7-37)。说明在EC中组蛋白调控、染色体结构与生长素信号等调控作用均发挥重要的作用。
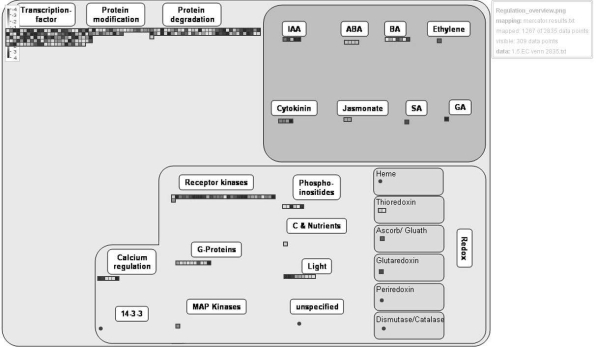
图7-35 百子莲1.5 mg/L PIC继代的胚性愈伤组织2 835个特异性表达基因生物调控过程功能注释
每个方格代表单独的基因,红色代表下调,蓝色为上调,颜色亮度表示差异程度(见标尺)

图7-36 百子莲1.5 mg/L PIC继代的胚性愈伤组织2 835个特异性表达基因细胞响应过程功能注释
每个方格代表单独的基因,红色代表下调,蓝色为上调,颜色亮度表示差异程度(见标尺)

图7-37 百子莲1.5 mg/L PIC继代的胚性愈伤组织2 835个特异性表达基因转录因子功能分类注释
每个方格代表单独的基因,红色代表下调,蓝色为上调,颜色亮度表示差异程度(见标尺)
对愈伤组织与胚性愈伤组织间的共表达差异基因进行聚类分析,这些基因的表达模式被分为13类(A-M)。其中下调表达的基因被分在Cluster A-H,其中Cluster B、C、E在1.5 mg/L PIC继代的EC中具有特异性表达的趋势;上调表达的基因分布于Cluster I-M中,各Cluster间基因的表达水平相差较大(见图7-38)。下调表达功能聚类中基因的蛋白功能分类主要包括:光合、淀粉与糖代谢、细胞壁、脂类代谢、氨基酸代谢、次生代谢、激素代谢、胁迫、氧化还原与运输。上调表达聚类中基因的蛋白功能分类主要含有细胞壁、脂类代谢、氨基酸代谢、激素代谢、胁迫、核苷酸代谢、RNA过程、DNA过程、蛋白过程、信号转导与发育(见图7-38)。
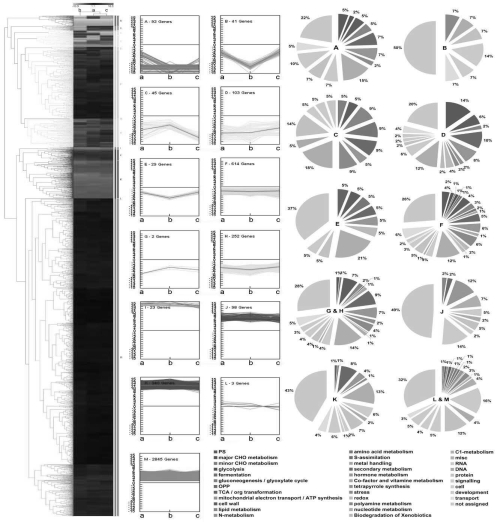
图7-38 百子莲愈伤组织与不同浓度PIC继代的胚性愈伤组织差异表达基因聚类分析与蛋白功能分类
a:Callus vs PIC_1.0_EC b:Callus vs PIC_1.5_EC c:Callus vs PIC_2.0_EC
每行代表单独的基因,红色代表上调,绿色为下调,颜色亮度表示差异程度(见标尺)
各组聚类结果的蛋白功能分类分析表明在Cluster F、M、K中含有转录因子相关基因,而其他聚类中没有发现转录因子存在。在下调表达的聚类Cluster F中主要包括MYB、b ZIP、Aux/IAA与ARF家族转录因子(见表7-6)。上调表达聚类Cluster M与K中主要包括AP2/EREBP、b ZIP、JUMONJI、MYB、WRKY、NAC、b HLH、CCAAT box与ARF家族转录因子(见表7-7,表7-8)。其中Aux/IAA属于生长素信号负转录调控因子,ARF为生长素信号调控激活子。这些转录因子的表达模式进一步证明生长素信号、乙烯信号在体胚诱导的过程中是持续增强的。
表7-6 Cluster F聚类中包含的转录因子列表

表7-7 Cluster K聚类中包含的转录因子列表

表7-8 Cluster M聚类中包含的转录因子列表

(续表)

不同浓度PIC继代的EC中,1.5 mg/L PIC继代的EC胚性保持较好且增殖速度较快。与其他两个浓度处理样品间DEGs进行筛选并进行聚类分析,所有DEGs共聚为9类(Cluster A-I),从图上看基因表达模式总体上可分为2大类:上调表达模式(Cluster A-E)与下调表达模式(Cluster G-I)(见图7-39)。对这2大类基因进行蛋白功能分类以进一步了解1.5 mg/L PIC与其他2个浓度PIC继代的EC间所存在的分子调控与代谢差异,如图7-39所示,在上调表达聚类Cluster A-E中的基因在蛋白功能分类上主要包括:细胞壁(6.9%)、次生代谢(7.9%)、激素代谢(6.9%)、RNA过程(6.4%)、蛋白(4.4%)、发育(3.5%)与运输(6.4%);在下调表达聚类Cluster G-I中的基因在蛋白功能分类上主要有RNA(11.3%)、DNA过程(15.1%)、次生代谢(3.2%)、胁迫响应(3.2%)、信号转导(4%)和细胞过程(8.6%)(见图7-39)。
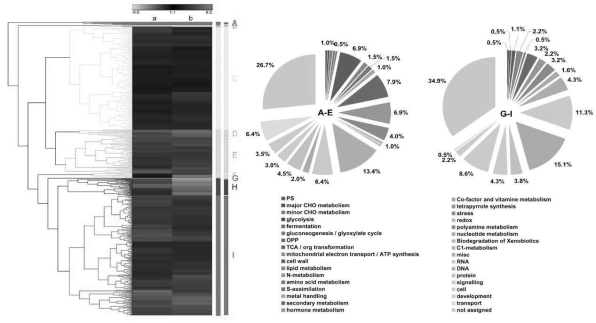
图7-39 不同浓度PIC继代的胚性愈伤组织间差异表达基因聚类分析
a:PIC_1.5_EC vs PIC_1.0_EC b:PIC_1.5_EC vs PIC_2.0_EC
每行代表单独的基因,红色代表上调,绿色为下调,颜色亮度表示差异程度(见标尺)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




