5.1.3.1 p TCK303质粒转化大肠杆菌
(1)取出制备好的大肠杆菌DH-5α感受态细胞于冰上化冻后,加入质粒DNA 1μL(10-100 ng),轻轻混匀后冰上放置30 min;
(2)移至42℃水浴中热激90 s,再迅速放回冰上冷却1~2 min;
(3)加入800μL不含抗生素的LB液体培养基于37℃震荡培养45 min;
(4)复苏后的菌液4 000 g离心5 min,弃掉800μL上清液;
(5)用枪头小心吹打混匀剩余的200μL菌液,将菌液涂布于含100 mg/L卡纳霉素的筛选平板上,37℃倒置培养;
(6)从平板上挑取阳性单克隆菌落进行鉴定和保存。
5.1.3.2 p TCK303质粒DNA的提取
溶液Ⅰ:Tris-HCl 50 mmol/L(p H7.5),EDTA(p H8.0)10 mmol/L。
溶液Ⅱ:NaOH 0.2 mol/L,SDS 1%(储备液:NaOH 0.4 mol/L,SDS 2%)。
溶液Ⅲ:KAc 1.32 mol/L(p H4.8),高压灭菌。
溶液Ⅰ和溶液Ⅲ在121℃灭菌后,存放于4℃冰箱使用。溶液Ⅱ先配制母液然后现用现配。
质粒DNA提取步骤:
(1)将阳性转化菌落接种到含相应抗生素的LB液体培养基中,37℃振荡培养16~18 h(180 r/min);
(2)4℃,12 000 rpm离心30 s,收集菌体;
(3)加入200μL溶液I(含RNase A 100μg/m L),震荡使菌体均匀悬浮,室温放置5~10 min;
(4)加入200μL新配制的溶液Ⅱ,轻柔颠倒混匀,冰浴放置5 min;
(5)溶液澄清后加入200μL预冷溶液Ⅲ,颠倒混匀,冰上放置5 min左右;
(6)4℃,12 000 rpm离心15 min。取上清液移到另一管中,加入0.7倍体积异丙醇振荡混匀,室温放置5 min;
(7)12 000 r/min离心10 min,70%乙醇洗涤沉淀,空气中干燥2 min后溶于TE,-20℃保存。
5.1.3.3 质粒DNA检测
将质粒DNA进行1%琼脂糖凝胶电泳,观察DNA条带大小。
构建质粒DNA单酶切体系(见表5-1),37℃水浴中酶切2~4 h后加入2μL 10×Loading Buf fer停止反应。将酶切后产物进行1%琼脂糖凝胶电泳,检测质粒DNA的各酶切位点。
表5-1 质粒DNA单酶切体系

5.1.3.4 RNAi载体构建
试验所用的RNAi干扰载体为p TCK303,其质粒结构图见图5-1。

图5-1 p TCK303质粒结构图
百子莲TIR 1基因的RNAi表达载体构建原理如图5-2所示。
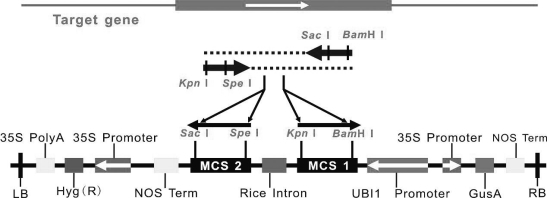
图5-2 RNAi表达载体结构及构建原理
5.1.3.5 总RNA提取与cDNA第一链合成
(1)总RNA提取方法同4.1.4.1。
(2)c DNA第一链合成。
在进行c DNA合成反应前,将纯化后的RNA溶液与65℃水浴加热5 min后迅速置于冰中,减弱二级结构的影响,以提高逆转录的反应效率。在离心管中配制下述反应液(见表5-2),建立逆转录反应体系。
表5-2 第一链cDNA合成反应体系

(1)混合均匀,室温放置10 min后,移至42℃恒温水浴中反应1 h;
(2)反应结束后放置于冰中冷却2 min。
5.1.3.6 TIR 1基因cds片段克隆
根据TIR 1基因全长序列,应用Primer 5.0软件设计引物。扩增片段选择不含质粒酶切位点序列,且在Genbank中进行Blast对比只有同源靶基因的序列,最终选择目标片段扩增长度为149 bp(1 234-1 382)。依据图5-2所示的构建策略,以RiTs与RiTa为引物(见表5-3),为扩增产物两侧引入SpeⅠ,SacⅠ,KpnⅠ,Bam HⅠ酶切位点(酶切位点识别序列见表5-3,表5-4)。PCR扩增体系(见表5-5)。取PCR扩增产物30μL进行琼脂糖凝胶电泳检测,特异性条带进行胶回收处理。回收条带进行p MD18-T载体链接,转化大肠杆菌测序,方法同4.1.4.6。
表5-3 TIR 1干扰序列引物列表

表5-4 限制性内切酶识别位点及反应条件
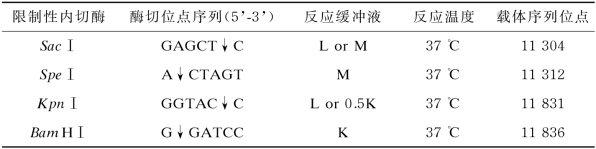
表5-5 TIR 1基因片段PCR扩增体系

5.1.3.7 TIR 1-cds片段正向连接(https://www.xing528.com)
用SacⅠ与SpeⅠ两个限制性内切酶对TIR 1-cds回收片段与载体p TCK303进行双酶切过夜,酶切体系见表5-6。
表5-6 TIR 1-cds片段与载体pTCK303的双酶切体系

将上述酶切产物按以下步骤进行纯化:
(1)加入与产物等体积的氯仿,剧烈震荡混匀,13 500 r/min离心10 min。
(2)取上清,加入1/10体积的3M Na Ac与2.5倍体积的无水乙醇,-20沉淀1 h,13 500 r/min离心5 min。
(3)加入30μL dd H 2 O溶解沉淀。
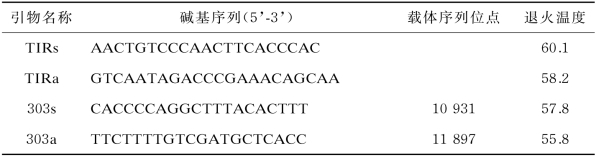
将纯化好的酶切产物按30∶1(DNA片段:载体)比例混合进行连接反应(见表5-7),16℃连接过夜。将连接产物转化大肠杆菌DH5α感受态,涂板筛选单克隆菌株进行目标片段PCR检测(引物序列见表5-8 TIRs与TIRa);在p TCK303载体多克隆位点(MCS)两侧设计上下游引物(见表5-8 303s与303a),进行质粒PCR检测,验证重组质粒中连接片段的长度。检测合格的菌液按照5.1.3.2方法提取质粒DNA。
表5-7 TIR 1-cds片段与载体pTCK303的连接体系

表5-8 TIR 1干扰载体构建PCR 检测引物列表
5.1.3.8 TIR 1-cds片段反向连接
将正向连接TIR 1-cds片段的p TCK303载体命名为p TCK303-sense。再进行TIR 1-cds片段反向连接。用KpnⅠ与Bam HⅠ两个限制性内切酶对TIR 1-cds回收片段与载体p TCK303-sense进行双酶切过夜,酶切体系如表5-9所示。
表5-9 TIR 1-cds片段与载体pTCK303-sense的双酶切体系

将上述酶切产物按5.1.3.7的方法进行纯化,将纯化好的酶切产物按30∶1(DNA片段:载体)比例混合进行连接反应(见表5-10),16℃连接过夜。将连接产物转化大肠杆菌DH5α,涂板筛选单克隆菌株进行菌液PCR与质粒PCR验证;按5.1.3.2方法提取质粒DNA,并利用SacⅠ内切酶对构建的质粒进行双酶切,检测连接片段的长度,载体构建正确的菌株送去测序。
表5-10 TIR 1-cds片段与载体p TCK303-sense的连接体系

将连有正、反向TIR 1-cds片段的p TCK303质粒标记为p TCK303-sense-intron-antisense,并存放于-20℃备用。
5.1.3.9 农杆菌感受态的制备
取-80℃保存的EHA105于含有50μg/m L链霉素的YEB平板划线(YEB配方见表5-11),28℃培养2天。挑单菌落接种于5 m L YEP液体培养基中(YEP配方见表5-12),28℃220 r/min震荡培养12~16 h。再取过夜培养的菌液1 m L接种于50 m L YEP液体培养基中,28℃震荡培养至OD600为0.5左右,将菌液转入1.5 m L的EP管中,4℃5 000 r/min离心5 min。搜集菌体,加入1 m L预冷的0.15 M NaCl溶液悬浮菌体,冰上放置20 min。4℃5 000 r/min离心5 min,去上清,将菌体悬浮于200μL预冷的200 m M CaCl2(含15%甘油)溶液中,液氮速冻,存于-80℃冰箱中备用。
表5-11 YEB培养基配方

表5-12 YEP培养基配方

∗固体培养基中添加。
5.1.3.10 表达载体冻融法转化农杆菌EHA105
(1)从-80℃取出EHA105感受态,置于冰上,缓慢融化。
(2)将1μL载体质粒DNA加入100μL感受态细胞中,用移液器混匀,冰上放置30 min。
(3)液氮中迅速冷冻处理5 min。
(4)37℃水浴5 min后冰浴放置2 min。
(5)加入1 m L YEB培养液,28℃,200 r/min培养3 h。
(6)离心收集菌液,沉淀用200μL YEB悬浮,将菌体涂布于含100 mg/L Kan YEB平板上,28℃培养48 h,直至长出清晰可见的单菌落,挑取单菌落进行PCR鉴定。
5.1.3.11 农杆菌侵染转化百子莲胚性愈伤组织
取出超低温冰箱中保存的含有p TCK303-sense-intron-antisense质粒的农杆菌菌株LBA4404,划线接种于含有50 mg/L卡那霉素、25 mg/L链霉素与50 mg/L利福平的YEB抗性培养基上,放置于28℃恒温培养箱中倒置培养2 d。从YEB抗性平板上挑取单菌落,接种于5 m L含有相应抗性的YEB液体培养基中,置于摇床上28℃(200 r/min)震荡培养过夜。取1 m L活化后的菌液接种于50 m L含相同抗性的YEB液体培养基中,相同条件下震荡培养至菌液浓度OD600值为0.2~0.5。4 000 r/min离心5 min,弃上清,搜集菌体,用MS培养基等体积悬浮菌体,使用时采用MS培养基(含1.5 mg/L PIC,30 g/L蔗糖,20 mg/L AS)稀释至原液体积的20~50倍。
(1)将百子莲胚性愈伤组织用农杆菌菌液浸泡2~3 min。
(2)用无菌滤纸吸干植物材料表面的菌液,将植物材料转入铺有一层滤纸的MS(含1.5 mg/L PIC,30 g/L蔗糖,20 mg/L AS)培养基上进行共培养,28℃暗培养5 d。
(3)共培养后,用MS液体培养基(含1.5 mg/L PIC,30 g/L蔗糖,500 mg/L Cb)悬浮植物材料,漂洗材料表面附着的菌体。
(4)漂洗后的材料用抽滤的方法转接到筛选培养基(MS+1.5 mg/L PIC+50 mg/L hygromycin+500 mg/L Cb+30 g/L蔗糖)上,放置于25℃恒温培养箱中进行暗培养,植物材料每2周继代一次,筛选转化细胞组织。
(5)筛选6~8周后,存活的胚性愈伤组织转接到分化培养(MS+500 mg/L Cb+30 g/L蔗糖)上,放置于25℃恒温培养箱中进行光照培养,进行体细胞胚诱导。
(6)2周后,当体细胞胚发育到3 mm大小时,将植物材料转接到不含生长调节剂与抗生素的培养基上(MS+30 g/L蔗糖),放置于25℃恒温培养箱中进行光照培养。
5.1.3.12 GUS组织化学分析
(1)将通过潮霉素抗性筛选的抗性细胞,放入GUS工作液中(配方见表5-13),37℃保温数小时或过夜。
(2)抗性细胞用75%的乙醇漂洗1~2次,直至阴性对照材料呈白色。
(3)用肉眼或解剖镜下观察拍照,白色背景下的蓝点即为GUS表达位点。
表5-13 GUS染色液配制方法

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




