pH是最常见的水质检测项目之一,在饮用水厂和污水厂中,pH检测涵盖了进水、出厂水及工艺过程检测,具有极大的普遍性。
在饮用水厂的每一个工艺段都要求测量pH值:
①检测进厂水pH值,可以快速检测出水源地人为或非人为因素引发的安全事故。
②pH数据可以帮助水厂运行人员确定工艺过程中的参数调整范围,如混凝沉淀工艺中的参数调整。
③要求在饮用水厂出厂水和给水管网中检测pH。
对于采用生物处理工艺的污水处理厂,由于微生物对pH变化的高敏感度,因此pH是生物法污水处理的关键检测指标之一:
①在曝气池中,如果pH值过高或过低,对水中污染物起降解作用的微生物在将“食物”(即水中污染物)转化为能量和“原材料”(即污染物被微生物降解后,其生长和繁殖可利用的小分子物质)的过程中受到抑制。
②如果硝化池中pH值下降过快,导致pH值偏低,在工艺中起硝化作用的硝化细菌就会受到抑制,进而影响硝化反应的效果。
③厌氧消化必须维持多个微生物种群数量的平衡,如果pH值超过了可接受的范围,那么甲醇的生成过程停止进而导致消化系统失效。
④每一座污水厂都要遵守统一的排放标准,pH是其中的一项重要的排放指标。
(1)pH在线检测方法及原理
在中性环境中,水分子发生电离反应,生成氢离子(H+)和氢氧根离子(OH-),二者浓度相等。
![]()
该反应是一个可逆反应,根据质量作用定律,对于纯水的电离可以找到一平衡常数K加以表示。

式中 [H+]——氢离子浓度,mol/L;
[OH-]——氢氧根离子浓度,mol/L;
[H2O]——未离解水的浓度,mol/L;因水的电离度很小,[H2O]=55.5 mol/L
水的电离受温度影响,加酸加碱都能抑制水的电离。水的电离是水分子与水分子之间的相互作用而引起的,因此极难发生。在一定温度下,K是常数,如25℃时K=1.8×10-16,所以K[H2O]也是常数,称为水的离子积,以KW表示。在25℃时:
KW=K×[H2O]=[H+]×[OH-]=10-7×10-7=10-14 mol/L
水的离子积KW只随温度变化而变化,是温度常数。在15~25℃,因变化很小通常认为是常数,即KW=10-14 mol/L,但当水的温度升高到100℃时,KW≈1×10-12 mol/L。
在水中逐渐滴加酸性溶液,氢离子浓度不断增加,同时氢氧根离子浓度不断降低;在水中逐渐滴加碱性溶液时,情况正好相反:氢离子浓度不断降低,而氢氧根离子浓度不断增加。
pH是氢离子浓度的测量值,pH的定义是:pH是水溶液中氢离子摩尔浓度的负对数。
pH=-log[H+]
Log是数学概念中的“对数”术语,pH数值的计算采用以10为底的常用对数,这也表明:pH每改变1个单位,氢离子浓度则改变了10倍。
典型的pH测量范围在0~14。
①pH=7表明溶液中氢离子浓度和氢氧根离子浓度相等,溶液的酸碱性呈中性。
②pH<7表明溶液中氢离子浓度高于氢氧根离子浓度,溶液酸碱性呈现酸性。
③pH>7表明溶液中氢氧根离子浓度高于氢离子浓度,溶液酸碱性呈碱性。
④pH<0和pH>14的情况时,溶液为强酸或强碱溶液,此时不用pH来表征。
由于pH是Log对数函数,所以溶液每改变1个pH单位,溶液中氢离子浓度就会有10倍的改变。pH值与氢离子浓度的关系如图9.6所示。

图9.6 pH值与氢离子浓度的关系
pH的测量主要依据能斯特方程,将化学能转换为电能的原电池或电解池相关的计算公式。能斯特(NERNST)方程可以用如下的计算式表达:
![]() (https://www.xing528.com)
(https://www.xing528.com)
式中 E——电动势,mV,指在真实条件下两个电极之间的电位差;
E0——标准电极电位,mV,指在标准温度、压力和浓度下两个电极之间的电位差;
R——通用气体常数,J/(mol·K);
T——绝对温度,单位是开尔文,开尔文温度与摄氏度之间的换算关系为:开尔文温度=273+摄氏度;
n——离子价态数;
F——法拉第常数,C/mol;
ai——离子活度。
(2)pH在线仪表结构
尽管pH值可以通过多种方法测量得出,对于pH电极而言,为了产生电势差,必须形成完整的电流回路。完整的电流回路是由插入同一溶液中的指示电极和参比电极构成,图9.7所示为参比电极和指示电极集成在一起的复合电极的结构。
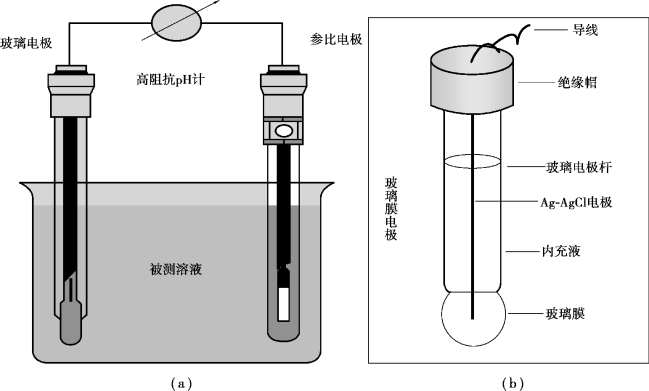
图9.7 pH复合电极示意图
无论待测溶液的组成如何,参比电极的功能主要是提供恒定电位;指示电极对氢离子敏感度高,主要功能是测量由于溶液中氢离子的存在而引起的电位变化(图9.8)。通过pH和电位关系的校准曲线,可以将两个电极之间的电位差转化为溶液的pH值。
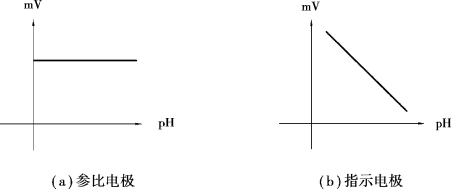
图9.8 参比电极与指示电极信号
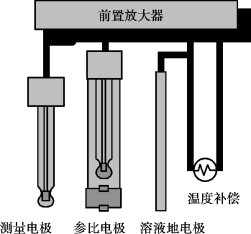
图9.9 pH电极结构
在能斯特公式中温度“T”作为变量,作用很大。随着温度的上升,电位值将随之增大。对于每1℃的温度变化,将引起电位0.2 mV/pH变化。则每1℃每1 pH变化0.003 3 pH值。这也就是说:对于20~30℃和pH=7左右的测量来讲,不需要对温度变化进行补偿;而对于温度高于30℃或低于20℃和pH>8或pH<6的应用场合,则必须对温度变化进行补偿。
现代的pH值检测采用差分传感器技术,使用三个电极取代传统的pH传感器中的双电极。测量电极和标准电极都与第三个地电极测量电位,最终测出的pH值是测量电极和标准电极之间电位差值。该技术大大提高了准确性,消除了参比电极的结点污染后造成的电位漂移,如图9.9所示pH电极结构。
最常用的pH电极称为复合电极,即参比电极和指示电极集成在一个电极上,其各个组成部分及作用如下。
1)参比电极
参比电极包含一个浸入参比电解质溶液中的参比单元,这个参比单元与待测溶液中的电解质构成一个电路连接。
参比电解质溶液通过一个多孔介质或者隔膜(有时称为“盐桥”)与待测溶液构成电路连接,该多孔介质或“盐桥”可以从物理上将内部电解质溶液与外部待测溶液隔离开。
最常用的参比电极是表面涂有固体氯化银(AgCl)的银电极(Ag)。选用银作电极的金属材料,原因在于:在所有金属中,银的导电性能最佳,电阻最小;氯化银(AgCl)的作用是提供一个稳定的参比电压。
2)盐桥或多孔介质
多孔介质或盐桥为参比电解液和待测溶液接触提供了一个微小的通道,但是不允许参比电解液和待测溶液相互混合。多孔介质或盐桥的作用是为参比电解液和待测溶液创造一个理想的接触条件。
3)参比电解液
参比电解液的主要作用是连接待测样品和pH计,其浓度必须非常高以减小电极电阻,保证在一定的温度范围内保持一个稳定的参比电极电位,从而不影响待测溶液的pH测量。最常用的参比电解液为饱和氯化钾(KCl)溶液。
氯化钾在20℃的溶解度是34 g,故20℃下饱和氯化钾溶液的浓度为25.37%。
4)温度传感器
为获得准确的测量值,pH传感器必须补偿因能斯特方程中温度变化造成的影响。
5)指示电极
指示电极是一种由特殊的玻璃材料烧结而成,该玻璃材料对氢离子浓度响应敏感,这种玻璃的主要成分为非结晶态的二氧化硅,掺入了一些碱金属氧化物,主要是金属钠的氧化物,即氧化钠(Na2O)。
当玻璃表面与水接触后,玻璃中的碱金属离子(Na+)以及溶液中的氢离子(H+)之间发生离子交换反应。一层非常薄的水合凝胶层在玻璃外表面形成,同时在玻璃泡内侧与内部缓冲溶液接触的表面也形成薄薄的一层水合凝胶层。
氢离子迁出或迁入水合凝胶层取决于待测溶液中氢离子的浓度。在碱性待测溶液中,氢离子从水合硅凝胶层中迁出,因此在水和硅胶层的外层产生负电荷;在酸性待测溶液中,氢离子迁入水合硅胶层,因此,在水合硅胶层中的外表面产生正电荷。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




