(一)定义
一种定量测试抗真菌药物对某一真菌的体外活性,能抑制待测真菌肉眼可见生长的最低药物浓度为最小抑菌浓度(MIC)或者与生长对照孔相比的最低有效浓度(MEC)的药敏试验方法。最低抑菌浓度(minimal inhibitory concentration,MIC),是指一种抗真菌药物抑制真菌生长至特定程度的最低药物浓度。最低有效浓度(minimal effective concentration,MEC),是指抗真菌药物可出现与生长对照孔菌丝相比较小的、圆的、紧密菌丝生长的最低药物浓度。
(二)原理
实验时,抗菌药物的浓度经过倍比稀释,能抑制待测真菌肉眼或显微镜下可见生长的最低药物浓度称为最低抑菌浓度(MIC)或者与生长对照相比的最低有效浓度(MEC),见图5-6-3。文献研究发现,宏量肉汤稀释法与肉汤微量稀释法在检测真菌药敏试验时具有较好的一致性。从生物安全性的角度考虑,有些实验室在检测真菌药敏试验时,选择使用宏量肉汤稀释法。但是,宏量肉汤稀释法并不适用于棘白菌素类抗真菌药物或者皮肤癣菌。

图5-6-3 阿尼芬净MEC结果的判读:尖端赛多孢孵育72 h的结果,茄病镰刀菌孵育48 h的结果,烟曲霉、黄曲霉分别孵育24 h的结果
(三)适用范围
产孢丝状真菌(仅包括非皮肤癣菌)。
(四)操作步骤
(1)抗真菌药物的准备
1)抗真菌药物的基本要求:抗真菌药物的获取应该选择直接从药物制造商或代理商处购买,不宜使用药房或者临床自制的药物。药物干粉应有清晰的商标,包括药物名称、生产日期、使用效期、生产批号和存储条件等。冻存的药物必须先室温平衡以后,再打开使用。
2)药敏试验试剂的制备
有机溶剂溶解:在配制抗真菌药物时,需要查看说明书以了解是否可用无菌水作为溶剂进行溶解。因为有些抗真菌药物不溶于水,所以配制时必须使用有机溶剂,可参考CLSI M61。配制抗真菌药物试剂前,可以从产品说明书上查见该药物的溶解度情况,配制的试剂浓度至少要比使用浓度高100倍。
常用的有机溶剂:分析纯的二甲亚砜(DMSO,dimethyl sulfoxide)、乙醇(Ethyl alcohol)、聚乙二醇(Polyethylene glycol)、羧甲基纤维素(Carboxy metlylcellulose)。
工作试剂的保存:通常情况下,储备试剂都要求是无菌的,为了更好地保证储备试剂的无菌,常使用带有滤膜的滤液器进行过滤处理。对于报纸、石棉等对大多数抗真菌药物具有吸附作用的滤液器,不宜使用。对配制好的试剂,应该进行适当的药物浓度和质量检测并记录。配制好的试剂,应该分装到无菌的小瓶或容器内密封保存,最好的保存温度是-60℃或者更低温度。取出的储存试剂,应该在当日进行使用,任何当日剩余的试剂都应该丢弃不宜再使用。通常抗真菌药物的储存试剂都可以在-60℃或者更低温度下保存6个月或更久,可以通过质控菌株的检测来评估药物是否还有效。
3)药物浓度要求:配制的抗真菌药物的浓度,应该考虑到折点或者ECVs,以及质控菌株的预期MIC值。根据早期研究的结果,对非皮肤癣菌和皮肤癣菌类丝状真菌的药物浓度要求是不一样的。
非皮肤癣菌的抗真菌药物浓度范围要求:两性霉素B、伊曲康唑、酮康唑、泊沙康唑、伏立康唑、艾沙康唑的药物浓度范围要求为0.031 3~16μg/ml。氟胞嘧啶和氟康唑的药物浓度范围要求为0.125~64μg/ml。棘白菌素类(阿尼芬净、卡泊芬净和米卡芬净)的药物浓度范围的要求为0.008~4μg/ml或者更低的浓度,特别是阿尼芬净和米卡芬净。
皮肤癣菌的抗真菌药物浓度范围要求:环吡酮胺的药物浓度范围要求为0.06~32μg/ml。氟康唑和灰黄霉素的药物浓度范围要求为0.125~64μg/ml。伊曲康唑、伏立康唑和特比萘芬的药物浓度范围要求为0.001~0.5μg/ml。泊沙康唑的药物浓度范围要求为0.004~8μg/ml。
(2)培养基与耗材的准备
1)培养基与耗材的准备要求:抗真菌药敏试验推荐使用全合成的培养基,RPMI 1640培养基(含有谷氨酰胺,不含有碳酸氢盐)是目前较好的丝状真菌药敏试验培养基,同时使用酚红作为pH指示剂更有利于药敏结果的观察。培养基应该在室温的条件下(25℃)调整至pH(7±0.1)为宜。Tris缓冲液不宜作为氟胞嘧啶的溶剂,因为Tris缓冲液的主要成分三羟甲基氨基甲烷会对氟胞嘧啶的药物活性造成拮抗反应。
推荐使用12 mm×75 mm 的一次性无菌非处理过的塑料管进行药物的稀释,检测时使用非处理过的96孔U型板进行测试。生长对照孔和生长质控,使用不含药物的RPMI 1640培养基(需求使用非水溶剂溶解)。注意避免使用处理过的塑料制品作为耗材,以防止某些抗真菌药物与其发生相互反应,推荐使用未处理过的塑料制品和玻璃器皿。
2)抗真菌药物的配制:水溶性的抗真菌药物试剂配制时,常使用倍比稀释法进行配制。配制时需要预先估算出需要的药物试剂用量,配制时保证富余的量,根据每孔0.1 ml的量计算,1 ml药物试剂用于9个梯度(孔)的检测足够了。非水溶性抗真菌药物试剂的配制,需要以1∶50倍稀释的方式在RPMI 1640培养基内进行稀释。
(3)受试菌和接种菌液:根据每孔0.1 ml的量计算,配制足够的抗真菌药物试剂备用,或者从-80℃冰箱取出药物的储存原液进行稀释使用。调制菌悬液,旋涡振荡混匀后调整菌液浓度在(0.4~5)×104 CFU/ml范围进行检测。
1)生物安全的要求:考虑到气溶胶、溅洒、操作环节等,建议制备菌悬液的工作在生物安全ⅡA或ⅡB级生物安全柜内操作。同时,考虑到丝状真菌的孢子或分生孢子很容易被吹散导致生物安全上的危险,操作培养有丝状真菌的平板等都应该在生物安全柜内进行。
皮炎芽生菌(Blastomyces dermatitidis)、球孢子菌属(Coccidioides spp.)、荚膜组织胞浆菌(Histoplasma capsulatum)、巴西副球孢子菌(Paracoccidioides brasiliensis)、斑替支孢瓶霉(Cladophialophora bantiana)、马尔尼菲篮状菌(Talaromyces marneffei)、喙枝孢属(Rhinocladiella mackenziei)等具有高致病性的真菌,需要有经验的操作人员在生物安全Ⅲ级实验室内进行。
2)非皮肤癣菌菌液的制备:绝大部分的真菌需要在PDA琼脂平板上35℃培养7 d,或者培养至成熟产生大量的分生孢子。对配置的菌悬液可以使用分光光度计或者比浊仪测量其浓度,配置的菌悬液浓度为(0.4~5)×104 CFU/ml。详见表5-6-1。
表5-6-1 非皮癣菌霉菌(Nondermatophyte Moulds)
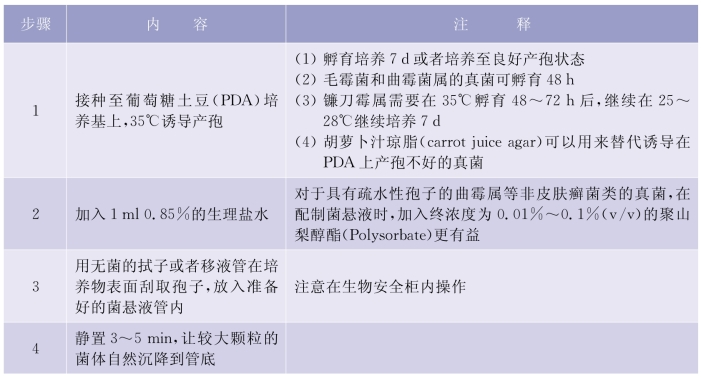
(续表)

3)皮肤癣菌菌液的制备:大部分皮肤癣菌菌株需要在PDA 平板上接种诱导产孢。但是,红色毛癣菌(Trichophytonrubrum)在标准培养基(包括PDA)上很难产生孢子,因此燕麦培养基(oat meal agar)被推荐作为红色毛癣菌(Trichophytonrubrum)的诱导产孢培养基。详见表5-6-2。
表5-6-2 皮癣菌霉菌(Dermatophyte Moulds)
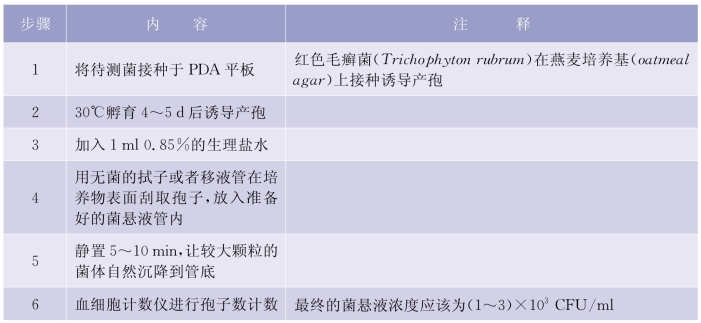
(4)接种菌悬液定量计数
1)非皮肤癣菌的菌落计数:可以将菌悬液取10μl并稀释10倍后进行涂布PDA 平板,在28~30℃培养每日观察计算菌落数。对于菌落的计数应该及时观察,尤其是根霉属(Rhizopus)和毛霉菌目(Mucorales)。菌落计数观察的时间应该控制在至少24 h(例如根霉属)至5 d(例如尖端赛多孢菌)。(https://www.xing528.com)
2)皮肤癣菌的菌落计数:可以将多于10μl的菌悬液涂布PDA平板,在28~30℃培养,每日观察计算菌落数。
(5)药敏结果的观察:肉汤微量稀释法和宏量肉汤稀释法的真菌药敏试验所接种的试管和96孔板,都应该在35℃培养并保证不被晃动,以便于观察到明显的生长情况。
1)非皮肤癣菌药敏观察时间要求:详见表5-6-3。
表5-6-3 MIC或MEC的观察推荐时间要求
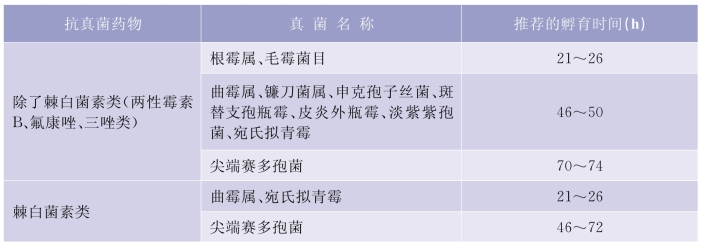
2)皮肤癣菌药敏观察时间要求:皮肤癣菌的MIC的判读,需要孵育4 d后观察。
(6)结果判读
1)两性霉素B的MIC判读:需要选择100%抑制的点进行判读,并且两性霉素B的生长通常不会遇到拖尾现象。
2)氟康唑、氟胞嘧啶和酮康唑的结果判读:与生长对照孔的一致性,非皮肤癣菌可以接受50%或者更高的浊度,皮肤癣菌可以接受80%或者更高的浊度。
3)伊曲康唑、泊沙康唑、伏立康唑、艾沙康唑的结果判读:非皮肤癣菌的MIC判读需要100%抑制。烟曲霉属和其他机会性感染真菌一般较少出现拖尾现象。
4)环匹罗司的结果判读:可以接受与生长对照孔的一致性为50%或者更高的浊度。
5)灰黄霉素和特比萘芬的结果判读:可以接受与生长对照孔的一致性为80%或更高的浊度。
(五)质控菌株及允许检测范围
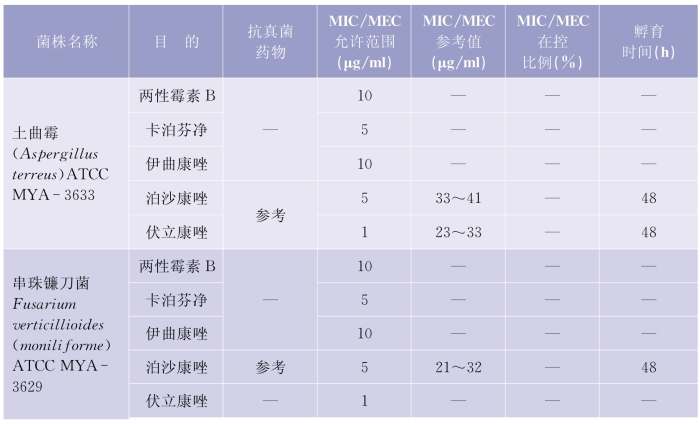
(1)质控检测频次:考虑到每做20个药敏试验测试时会发生随机误差,建议每20个测试后需要核对确认检测体系的可靠性。质控检测的周期推荐每周检测,在30个连续的工作日,应该覆盖所有质控菌株的检测。详见表5-6-4(下页)、表5-6-5(第97页)。
表5-6-4 肉汤稀释法检测产孢丝状真菌质控菌株的MIC和MEC允许范围
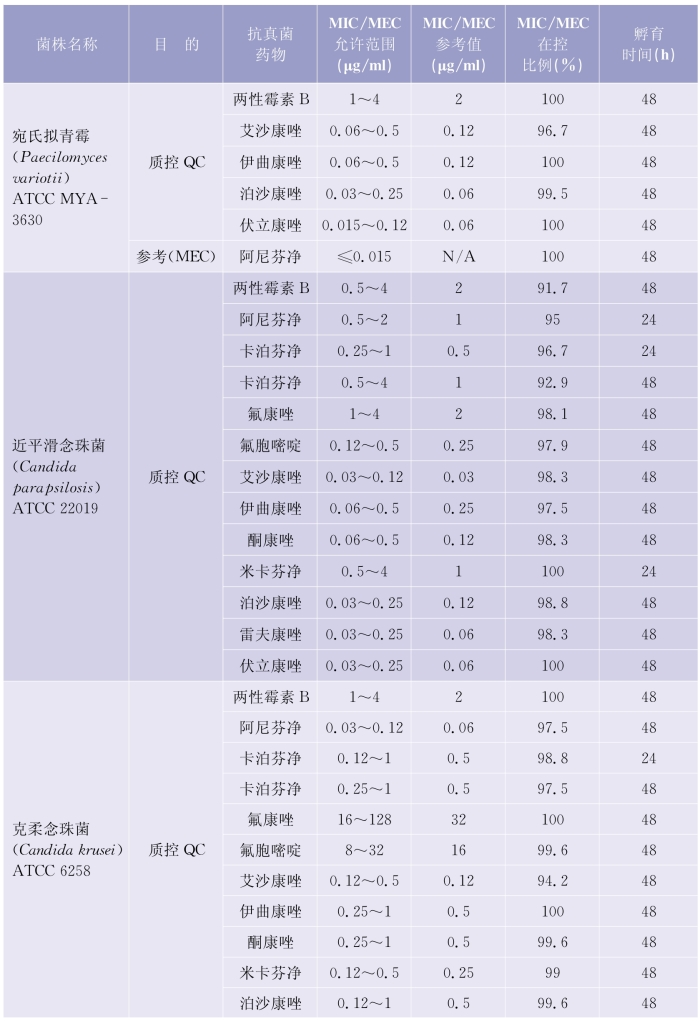
(续表)
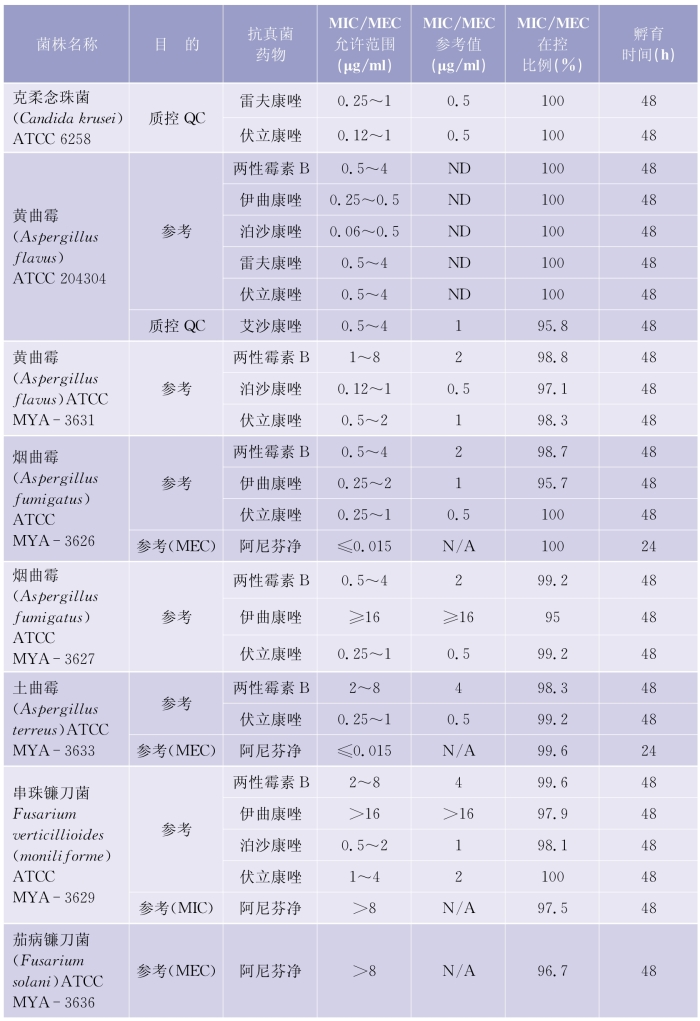
(续表)
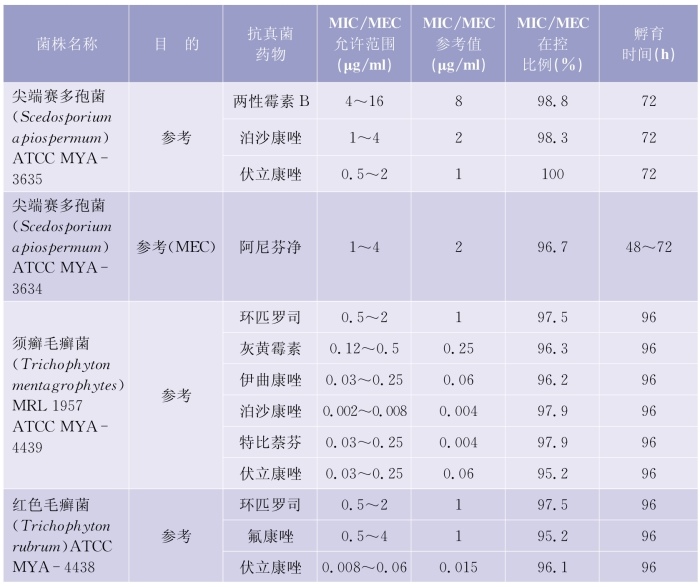
表5-6-5 纸片扩散法检测产孢丝状真菌质控菌株的MIC和MEC允许范围
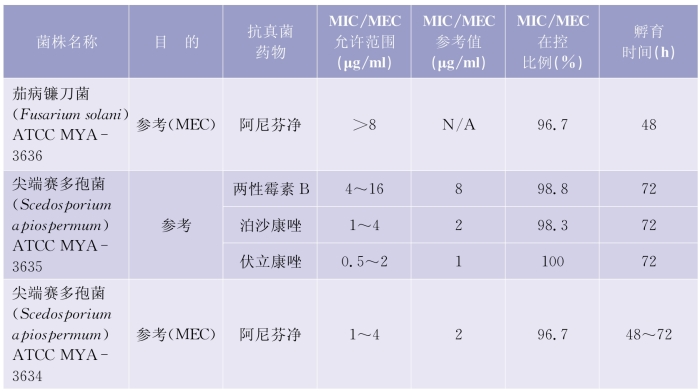
(续表)
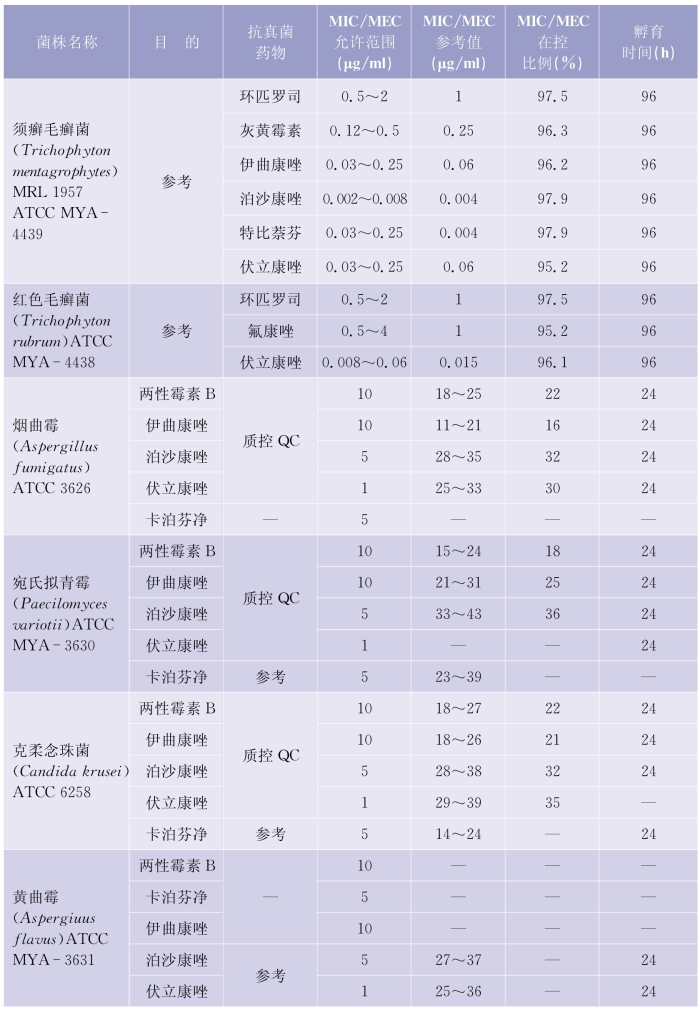
(续表)
(六)药敏报告信息
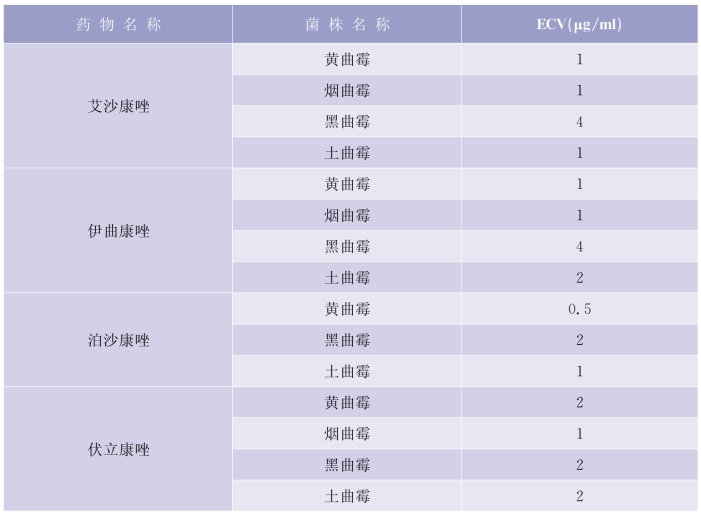
CLSI文件中,丝状真菌只有流行病学界值(ECV),见表5-6-6。ECV(在CLSI M59,2018)不能作为临床折点使用。因为临床折点(BP)代表预测患者治疗成功可能性的MIC值,是基于MIC分布、PK/PD数据和临床结局数据而来的;流行病学界值(ECV)表示耐药出现的MIC值,基于菌株表型将菌分为获得突变“耐药”和不获得突变“耐药”。对于已经确定ECV的菌株,抑菌圈直径和MIC值不能被解释或报告成敏感、中介、耐药,而应报告为野生型和非野生型。
表5-6-6 多种曲霉属丝状真菌的流行病学界值(ECV)
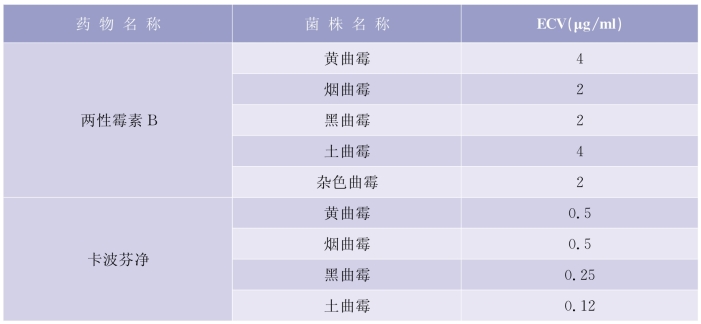
(续表)
2020年CLSI M61(第二版)新增加了烟曲霉(A.fumigatus)对伏立康唑的MIC折点:≤0.5μg/ml判读为敏感(S),1μg/ml判读为中介(I),≥2μg/ml判读为耐药(R)。该折点不推荐用于烟曲霉复合群其他菌种药敏试验关于伏立康唑的MIC结果判读。
(作者:郭建 校审:吴文娟)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




