若溶液中同时存在某电对的氧化型和它的还原型物质,如含有I2及I-的溶液,插入一支铂电极,按照Nernst关系式(25℃)
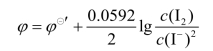
若同时插入两个相同的铂电极,因两个电极电位相等,不会发生任何电极反应,没有电流通过电池。若在两个电极间外加一个小电压,则接正极的铂电极将发生氧化反应,即
正极氧化反应:![]()
负极还原反应:![]()
但只有两个电极同时发生反应,它们之间才会有电流通过,像I2/I-这样的电对称为可逆电对。当被测物属于可逆电对,电对到半滴定点(滴定完成一半时,即被滴定物电对氧化型和还原型的浓度为等化学计量时,通过的电流最大;当氧化型和还原型的浓度不等计量时,电流由浓度小的氧化型(或还原型)物质的浓度所决定。
若某电对氧化型和还原型的溶液,在上述条件下不发生电解作用,没有电流通过,这种物质电对称为不可逆电对,如![]() 电对即属于不可逆电对。即属于不可逆电对。对于不可逆电对,只有外加电压很大时才会产生电解作用,这是发生了其它类型的电极反应。
电对即属于不可逆电对。即属于不可逆电对。对于不可逆电对,只有外加电压很大时才会产生电解作用,这是发生了其它类型的电极反应。
永停滴定法便是利用待测物和滴定剂电对的可逆性对电流作用的特殊性来确定滴定终点的到达。永停滴定法的i-V关系曲线可能有以下三种不同情况。
1.滴定剂属可逆电对,被测物属不可逆电对(https://www.xing528.com)
用碘滴定硫代硫酸钠就属于这种情况。在滴定终点前,溶液中只有![]() 电对,因为它们是不可逆电对,虽然有外加电压,电极上也不发生电解反应。另外,溶液虽然有滴定反应产物I-存在,但I2浓度一直很低,不会发生明显的电解反应,所以电流计指针一直停留在接近零电流的位置上不动。一旦达到滴定终点(化学计量点)并有稍过量的I2加入后,溶液中建立了明显的I2/I-可逆电对,电解反应得以进行,产生的电解电流使电流计指针偏转并不再返回零电流的位置。随着过量I2的加入,电流计指针偏转角度增大。滴定时的电流变化曲线如图12-16(a)所示,Ve(mL)为化学计量点滴定剂体积,曲线的转折点即滴定终点。
电对,因为它们是不可逆电对,虽然有外加电压,电极上也不发生电解反应。另外,溶液虽然有滴定反应产物I-存在,但I2浓度一直很低,不会发生明显的电解反应,所以电流计指针一直停留在接近零电流的位置上不动。一旦达到滴定终点(化学计量点)并有稍过量的I2加入后,溶液中建立了明显的I2/I-可逆电对,电解反应得以进行,产生的电解电流使电流计指针偏转并不再返回零电流的位置。随着过量I2的加入,电流计指针偏转角度增大。滴定时的电流变化曲线如图12-16(a)所示,Ve(mL)为化学计量点滴定剂体积,曲线的转折点即滴定终点。
2.滴定剂为不可逆电对,被测物为可逆电对
用硫代硫酸钠滴定稀碘(I2)溶液即属于这种情况。从滴定开始到化学计量点前,溶液存在I2/I-可逆电对,有电解电流通过电池。电流的大小取决于溶液中滴定产物的浓度c(I-),c(I-)由小变大,电解电流也由小变大,在半滴定点电流值最大。越过半滴定点,电流的大小改为取决于溶液中剩余I2的浓度,c(I2)逐渐变小,电解电流逐渐变小,直至化学计量点,c(I2)趋于0,电流值也趋于0。化学计量点后,溶液中虽然有不可逆的![]() 滴定剂电对,但无明显的电解反应。因此,越过化学计量点后,电流将停留在零电流附近并保持不动。滴定时的电流变化曲线如图12-16(b)所示。此类滴定法是根据滴定过程中,电流下降至零,并停留在原地不动的现象确定滴定终点,历史上以此得到永停滴定法的名称,并沿用至今。
滴定剂电对,但无明显的电解反应。因此,越过化学计量点后,电流将停留在零电流附近并保持不动。滴定时的电流变化曲线如图12-16(b)所示。此类滴定法是根据滴定过程中,电流下降至零,并停留在原地不动的现象确定滴定终点,历史上以此得到永停滴定法的名称,并沿用至今。
3.滴定剂与被测物均为可逆电对
铈离子滴定亚铁离子属于这种情况。在化学计量点前,电流来自溶液中Fe3+/Fe2+可逆电对的电解反应,电流的变化机理和i-V关系曲线与图12-16(b)中化学计量点前的情况相同,滴定终点时电流降至最低点。终点过后,随着Ce4+的加入,Ce4+过量,溶液中建立了Ce4+/Ce3+可逆电对,有电流通过电解池,电流开始上升,随着过量Ce4+的加入,电流计指针偏转角度增大。其i-V关系曲线如图12-16(c)所示。
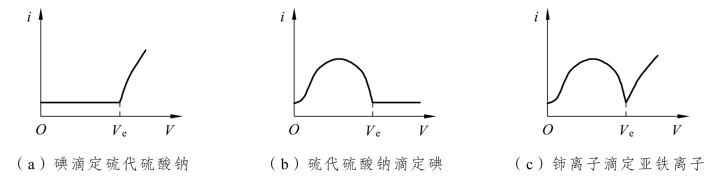
图12-16 永停滴定法的滴定曲线
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




