化学电池是一种电化学反应器,通常由两个电极和电解质溶液组成。电化学反应是发生在电极与电解质溶液界面间的氧化还原反应。化学电池可由两种电极插在同一种溶液中组成,称为无液接界电池;也可以由两个电极分别插在两种组成不同,但能相互连通的溶液中组成,这种电池称为有液接界电池。在有液接电池中,通常用某种多孔性物质隔膜将两种溶液隔开,或用一盐桥将两种溶液连接起来,其目的是阻止两种溶液混合,又为通电时的离子迁移提供必要的通道。电位分析法主要利用有液接界电池。
根据电极反应是否自发进行,化学电池又分为原电池和电解池。原电池的电极反应自发进行,是一种将化学能转化为电能的装置;电解池的电极反应是非自发进行,需要在两个电极上施加一定的外电压,电极反应才能进行,它是一种将电能转化为化学能的装置。这两类电池在电化学分析中均有应用。视实验条件不同,有时同一电池既可作为原电池,又可作为电解池起来使用。可以认为这种区分的依据是电池的工作状态不同,而不是它们的结构不同。
例如,将金属锌棒插入1.0mol/L的ZnSO4溶液中,将金属铜棒插入1.0mol/L的CuSO4溶液中,组成两个半电池,中间以饱和KCl琼脂凝胶盐桥连接,两个电极与外电路电流计连接,构成一个有封闭回路的原电池,如图12-1所示。
电池图解表示式为
(-)Zn|ZnSO4(1.0mol/L)||CuSO4(1.0mol/L)|Cu(+)
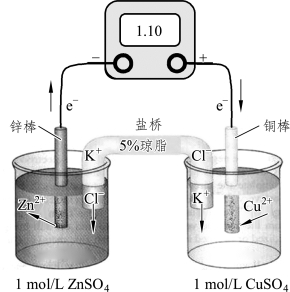
图12-1 铜锌原电池示意图
电池图解表示式的书写规则如下:
(1)发生氧化反应的电极写在左边,是负极;发生还原反应的电极写在右边,是正极。
(2)以符号“|”表示不同物相之间的接界,同一物相中的不同物质之间用逗号隔开,两种溶液通过盐桥连接,用“||”表示。
(3)电解质溶液位于两电极之间,应注明浓度,如为气体则应注明压力。
锌极上是Zn失去电子变成Zn2+而逐渐溶解进入溶液的过程,发生氧化反应,为负极:
![]() (https://www.xing528.com)
(https://www.xing528.com)
铜极上是溶液中Cu2+获得电子变成Cu而逐渐沉积其上的过程,发生还原反应,为正极:
![]()
电池总反应为
![]()
电池电动势定义为
![]()
计算的E电池为正值,该电池为原电池;若为负值,该电池则为电解池。上述铜-锌原电池的电动势为E电池=0.337V-(-0.763V)=1.100V,说明该电池为原电池。
如果将一个外电压E外>E电池的电源反向外加于上述电池的两极,电极反应和电流方向将发生改变:
锌极发生还原反应,转变为阴极:![]()
铜极发生氧化反应,转变为阳极:![]()
电池总反应则为电解反应:![]()
电解反应是在消耗外电源电能的条件下完成的,电解池是将电能转化为化学能的装置。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




