分子排阻色潽法又称体积排阻色谱法,由于它是以多孔凝胶为固定相,也称为凝胶色谱法。根据流动相不同分为两种:以有机溶剂为流动相的称为凝胶渗透色谱法(GPC),主要用于高聚物的分子量测定;以水溶液为流动性的称为凝胶过滤色谱法(GFC),主要用于蛋白质、生物酶、寡聚或多聚核苷酸、多糖等生物分子量的测定。
1.分离机理
分子排阻色谱法的分离过程是使具有不同分子大小的样品,通过多孔性凝胶(软性凝胶或刚性凝胶)固定相,借助精确控制凝胶孔径的大小,使样品中大的分子不能进入凝胶孔洞而完全被排阻,只能沿多孔凝胶离子之间的缝隙通过色谱柱,首先从柱中被流动相洗脱出来;中等大小分子能进入凝胶一些适当的孔洞中,但不能进入更小的微孔,在柱中受到滞留,较慢地从柱中洗脱出来;小分子可进入凝胶的绝大部分孔洞,在柱中受到更强的滞留,会更慢地被洗脱出来,从而实现对样品中不同分子大小组分的完全分离,如图8-4所示。溶剂分子最小,可自由进出凝胶的所有孔洞。
对于孔隙之所以对分子大小不同的分子具有筛分作用,可参考凝胶圆锥形空洞模型来解释(图8-5)。因分子尺寸大小不同,它们自由扩散能够到达孔洞的深度不同。大尺寸分子只能扩散到孔洞很浅的位置,返回到孔外很容易,相当于保留很弱,随流动相移行速度快,移行距离靠前一点;中等尺寸分子,可自由扩散到孔洞中等深度的位置,返回到孔外比大尺寸分子耗时略长一些,相当于有一定保留作用,它随流动相移行速度比大尺寸分子略慢一些,移行距离紧随之后;较小尺寸分子可自由扩散到孔洞的更深位置,再返回到孔外耗时更长一些,相当于保留作用较强,它随流动相移行速度更慢,移行距离最滞后;溶剂分子尺寸最小,可扩散到孔洞的最深位置,返回到孔外耗时最长,移行最慢。所以,不同尺寸大小的分子,每进出一次孔洞,它们的移行距离都存在着微小差异,经过整个柱长的移行,这微小差别在动态中得到无数次累加而放大,大尺寸分子最先流出色谱柱、中等尺寸分子紧随其后流出色谱柱、较小尺寸分子滞后流出色谱柱,溶剂小分子最后流出色谱柱,从而将不同尺寸大小的分子分离开来。
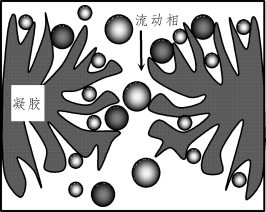
图8-4 分子排阻色谱示意图
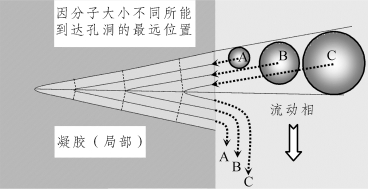
图8-5 凝胶圆锥形孔洞对分子排阻示意图
应当指出溶解样品的溶剂分子最后从凝胶色谱柱中流出,这一点明显不同于前述的各种液相色谱法,因此与溶剂分子流出对应的时间应为死时间,其对应的洗脱体积为柱的死体积。
由上述分离过程可以看出,样品中相同大小的溶质分子,在凝胶孔洞的内外处于扩散平衡状态。平衡时,组分在孔洞内外(相当于两相)中的浓度之比称为渗透系数Kp为

式中,VR为组分的淋洗体积;Vs为固定相孔内总体积;V0为死体积。
当Vp=V0时,Kp=0,即组分被完全排除;当VR-V0=Vs时,Kp=1,则组分分子完全渗透到固定相中。注意这里Kp和前三种类型色谱不同,Kp为溶质淋洗体积占固定相体积的比例,其值一般总是小于1。这种分离主要取决于凝胶的孔径大小与被分离组分分子尺寸之间的关系,与流动相的性质没有直接关系。
由具有一定粒度和不同孔径凝胶构成的色谱柱,所能分离样品的分子量(M)的范围,是由组分从柱中洗脱时的洗脱体积(Ve)的差别来表示的。为表示此凝胶色谱柱的特性,可以绘制lgM-Ve校正曲线,如图8-6所示。图中A点为排阻极限(Kp=0),即相当于分子量大于106的分子被排斥在凝胶孔穴之外,以单一谱带A′流出柱外,对应保留体积为V0。图中B点为渗透极限(Kp=1.0),相当于分子量小于102的小分子都可完全渗入凝胶孔穴内,以单一谱带B′流出柱外,对应保留体积为V0+Vp。从图示可知,只有分子量介于A~B两点(KD=0~1.0)之间的组分X′可以进入凝胶的不同孔穴进行渗透分离,对应的保留体积为Vx。通常将A、B两点间的分子量范围叫作凝胶色谱柱的分级范围,由此可知,只有凝胶的孔穴体积Vp才是具有分离能力的有效体积。
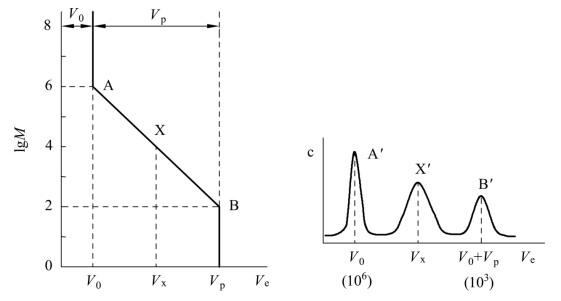
图8-6 凝胶色谱的lgM-Ve校正曲线
体积排阻色谱法的分离机理是独特的,其洗脱体积总是介于V0~(V0+Vp)。因此凝胶色谱柱的峰容量是有限的,在整个色谱图上只能容纳小于10~12个色谱峰,而不像其它液相色谱方法那样在一次分离中可以分开几十至几百个化合物。这表明体积排阻色谱法的分离度较低,因此仅该方法还不能完全分离一个复杂的、含多组分的样品。
此外,体积排阻色谱法不宜用于分子大小组成相似或分子大小仅差10%的组分分析,如同分异构体的分离就不能采用该方法。
2.实验方法
(1)凝胶柱的选择和使用
经典液相色谱中的体积排阻色谱分离模式主要用于制备分离、精制纯化。根据分离对象不同,有GPC和GFC,必须注意凝胶的性质与溶质和淋洗体系相匹配。SEC要求凝胶与样品尽可能不发生任何基团之间的相互作用,即在色谱过程中尽可能避免非体积排阻色谱效应(如吸附、分配、离子交换等)的影响,而是完全按照分子尺寸大小进行分离。(https://www.xing528.com)
GPC(凝胶渗透色谱),通常都是在有机溶剂(如THF)淋洗体系中进行,与之匹配的凝胶是疏水性的,其分离对象一般是油溶性的高分子化合物。
GFC(凝胶过滤色谱),通常是在水相(如缓冲液)淋洗体系中进行,与之匹配的凝胶是亲水性的,其分离对象一般是水溶性的大分子化合物。
按分子量范围考虑:应落在分子量-淋出曲线的线性部分;若范围太窄则可以考虑将不同规格的柱子串联使用。
使用中最大的问题是严禁超压,否则将会引起凝胶孔结构的破坏,使柱子完全报废。使用后应妥善保管,防止干裂、盐析、生霉。由于使用了缓冲溶液以及无机盐溶液,故必须以纯水冲洗干净。较长时间不使用时,可用甲醇或含叠氮化钠的水溶液置换后,密封保存。
(2)流动相
GPC中,主要考虑高分子样品的溶解度,检测器的要求,处理的方便及安全性、经济性等因素。特别是常用的四氢呋喃,在纯化时还要考虑生成过氧化物的危险。
GFC中,主要考虑添加中性盐及缓冲液等问题。
(3)标准样品及标准曲线
SEC不是一个绝对的测定方法(有在线分子量检测器的除外)。因此通常需要用标准样品标定出淋洗体积与分子量之间的关系。对于GPC,可采用窄分布的标样,如分子量分布窄的聚苯乙烯(PS),其分子量一般在600~3×106;对于GFC,可采用蛋白质标样,其分子量是精确的,故可绘出精确的标准曲线,但昂贵的价格限制了它的广泛应用,亦可用葡聚糖或PEG来代替,但它们是线性分子且不是单分散的,故有局限性,其数据仅供参考。为了解决普适标定问题,以特性黏数对流体力学体积[η]M作图(η特性黏数,M平均分子量),再通过换算求出试样的lgM-Ve标准曲线;当淋出体积相同时,[η]1M1=[η]2M2。
根据特性黏数-分子量方程式[η]=K1Mα,可得出

只要待测样品的K2、α2已知,便可以推知其分子量M2。
3.应用示例
β-内酰胺抗生素是目前临床上最常用的抗感染药物,但它们在临床上常引发过敏性休克反应,严重威胁患者的安全。经研究证明,引发过敏反应的过敏原与β-内酰胺抗生素中存在的高分子聚合物含量有关,对此类药物中高分子聚合物的测定引起人们的重视。所以《中国药典》增加了许多须做高分子聚合物测定的β-内酰胺抗生素,如头孢辛钠、头孢拉定、头孢唑林钠、阿莫西林、青霉素等,并且在附录中增加了分子排阻色谱法。
(1)色谱条件与系统适用性试验
用葡聚糖凝胶G-10(40~120μm)为填充剂,玻璃柱内径1.0~1.4cm,柱长30~45cm。以pH8.0的0.2mol/L磷酸盐缓冲液[0.2mol/L Na2HPO4-0.2mol/L NaH2PO4(95∶5)]为流动相A,以水为流动相B,流速为每分钟1.0~1.5mL,检测波长为254nm。量取0.2mg/mL蓝色葡聚糖2000溶液100~200μL,注入液相色谱仪,分别以流动相A、B进行测定,记录色谱图。按蓝色葡聚糖2000峰计算理论板数均不低于400,拖尾因子均应小于2.0。在两种流动相系统中蓝色葡聚糖2000峰的保留时间比值应在0.93~1.07,对照溶液主峰与供试品溶液中聚合物峰与相应色谱系统中蓝色葡聚糖2000峰的保留时间的比值均应在0.93~1.07。称取头孢拉定约0.2g,置10mL量瓶中,加2%无水碳酸钠溶液4mL使溶解后,加0.6mg/mL的蓝色葡聚糖2000溶液5mL,用水稀释至刻度,摇匀。量取100~200μL注入液相色谱仪,用流动相A进行测定,记录色谱图。高聚体的峰高与单体与高聚体之间的谷高比应大于2.0。另以流动相B为流动相,精密量取对照溶液100~200μL,连续进样5次,峰面积的相对标准偏差应不大于5.0%(对照溶液进行测定前,先用含0.2mol/L氢氧化钠与0.5mol/L氯化钠的混合溶液200~400mL冲洗凝胶柱,再用水冲洗至中性)。
(2)对照溶液的制备
取头孢拉定对照品,精密称定,加水溶解并定量稀释制成约含头孢拉定10μg/mL溶液。
(3)测定法
取本品约0.2g,精密称定,置10mL量瓶中,加2%无水碳酸钠溶液4mL,使溶解后,用水稀释至刻度,摇匀。移取取100~200μL注入液相色谱仪,以流动相A进行测定,记录色谱图。另精密量取对照溶液100~200μL注入液相色谱仪,以流动相B为流动相进行测定,记录色谱图。按外标法以峰面积计算,含头孢拉定聚合物以头孢拉定计不得超过0.05%。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




