化学键的电子构型(σ键、π键、孤对电子)决定了化合物的结构和性质,分子吸收光能后由基态跃迁到激发态,反映了光能与化学键的内在联系,这是通过检测物质的紫外-可见吸收光谱来分析物质结构和含量的根本原因。下面介绍紫外吸收光谱与分子结构的关系。
1.电子跃迁类型
在化合物中,处于σ轨道上的称为σ电子,处于π轨道上的电子称为σ电子,处于原子轨道的电子称为n电子,都处于基态;还有σ*、π*两个反键轨道是空置的。当紫外-可见光照射化合物时,可发生如下电子跃迁类型(图2-4)。
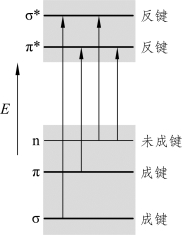
图2-4 分子中电子能级跃迁示意图
(1)σ→σ*跃迁
分子中的σ轨道的能级最低最稳定,因此σ电子需要较大的能量才能被激发,只有远紫外区短波长(λ<150nm)的辐射能才满足要求,所以σ→σ*跃迁的吸收带在真空紫外区,一般观察不到。饱和型化合物的吸收带就是
σ→σ*跃迁吸收带,一般无峰形,如图2-5所示。四甲基硅烷有两种σ键的吸收带,![]() 键的吸收峰为164.09nm,
键的吸收峰为164.09nm,![]() 键的吸收带为强末端吸收,无峰形。
键的吸收带为强末端吸收,无峰形。
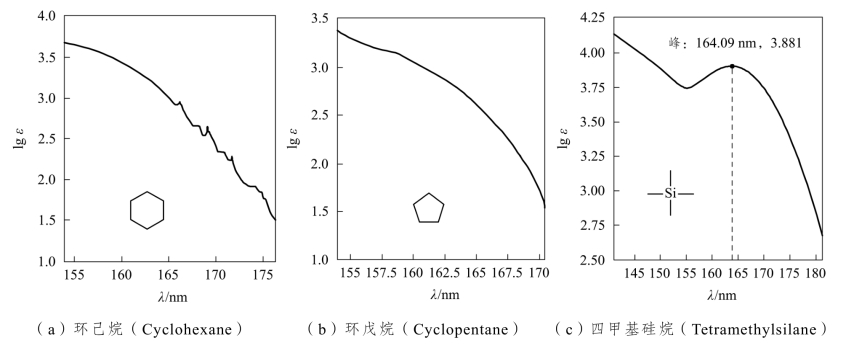
图2-5 三个饱和型化合物的远紫外吸收光谱
(2)n→σ*跃迁
在饱和烃的含氧、氮、硫、磷、卤素的衍生化合物中,其杂原子上有未成键的孤对电子(简称n电子),在紫外光的照射下,除有σ→σ*跃迁外,还有n→σ*跃迁。n→σ*跃迁所吸收的波长在200nm左右(图2-6)。
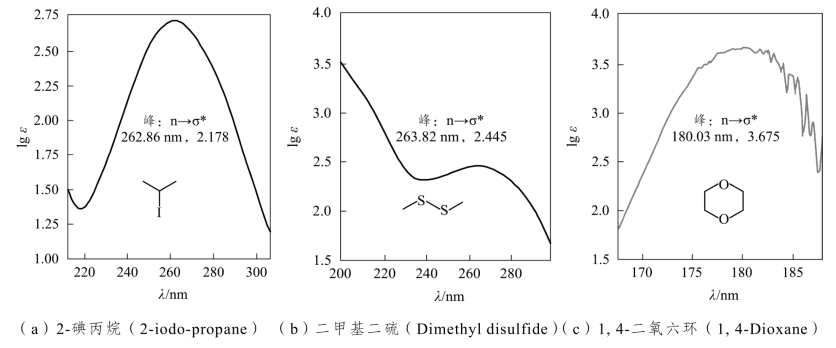
图2-6 三个化合物的紫外吸收光谱图
(3)π→π*跃迁
处于π轨道电子跃迁到π*上,所需能量低于σ→σ*跃迁![]() 键的π→π*跃迁吸收的波长在170~200nm[图2-7(a)],同一分子有多个不共轭双键时,吸收波长与单个双键相同;分子有共轭
键的π→π*跃迁吸收的波长在170~200nm[图2-7(a)],同一分子有多个不共轭双键时,吸收波长与单个双键相同;分子有共轭![]() 键时,由于π电子的共轭离域,使π→π*跃迁所需能量降低,吸收波长长移,吸收强度也增大[图2-7(b)(c)]。
键时,由于π电子的共轭离域,使π→π*跃迁所需能量降低,吸收波长长移,吸收强度也增大[图2-7(b)(c)]。
(4)n→π*跃迁
含有杂原子的不饱和化合物,其孤对电子吸收能量后,发生n→π*跃迁,吸收波长一般在200~400nm近紫外区,吸收强度弱至中强都有(图2-8)。当分子有p-π超共轭时,使π电子离域,跃迁能量降低,使其π→π*跃迁和n→π*跃迁吸收峰长移,吸收强度增加。
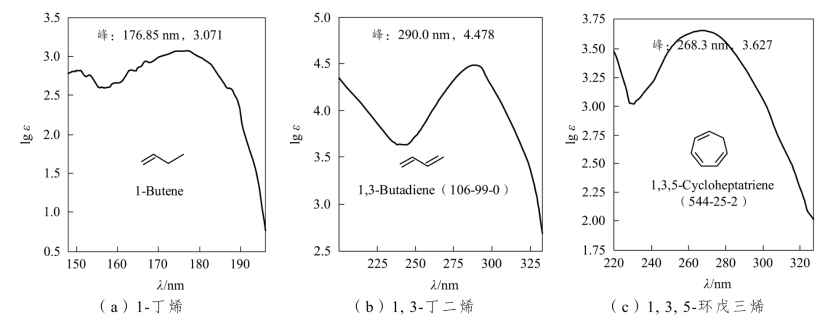
图2-7 烯烃的紫外吸收光谱图
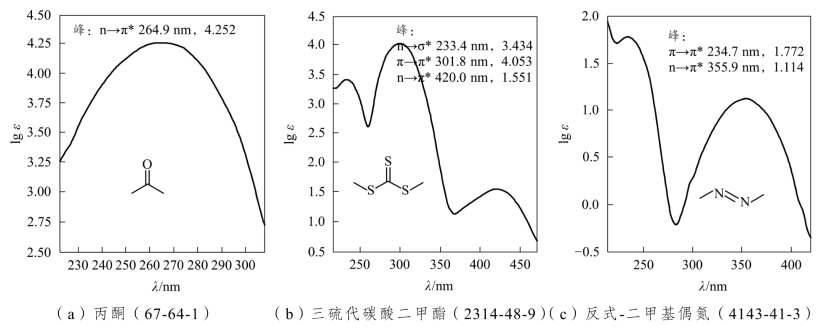
图2-8 三个含杂原子不饱和基团化合物的紫外吸收光谱图
产生n→π*跃迁的基团如下:

比较上述4种跃迁类型跃迁所需能量与吸收波长的大小顺序分别为
ΔE:σ→σ*>n→σ*>π→π*>n→π*
λmax:σ→σ*<n→σ*<π→π*<n→π*
对于某一具体化合物而言,上述四种跃迁并不是孤立存在的,应该综合考虑化合物元素组成和成键类型等,才能得出全面的判断。
(5)荷移跃迁
当电子给予基团与电子接受基团直接相连(紧邻)处于同一分子内时,或电子给予体分子与电子接受体分子处于同一个体系中,在紫外-可见光照射下,电子由给予体向接受体相联系的轨道上跃迁,称为电荷迁移跃迁,简称荷移跃迁。由此而产生的吸收光谱法称为荷移跃迁光谱法。荷移跃迁可以理解为在光能辐射下的分子内或分子间的氧化-还原过程。
例如,苯胺的苯环为电子接受基、胺基为电子给予基,能产生荷移跃迁吸收;苯乙酮的苯环为电子给予基、羰基为电子接受基,也能产生荷移跃迁吸收。
无机离子形成的配合物也能产生荷移跃迁吸收。例如,过渡金属离子(M,电子给予基)与含有生色团(L,电子接受基)的试剂反应生成的配合物(ML),可产生荷移跃迁吸收。
M—L—h—ν→M+—L-
具有d10电子结构的过渡金属元素形成的卤化物及硫化物有显著的颜色,就是因为它们吸收可见光中的部分光产生荷移跃迁,从而显示出颜色。例如,AgBr淡黄色、PbI2黄色、HgS黑色等。
荷移跃迁吸收的波长取决于电子给予体与接受体相应电子轨道的能量差。中心离子的氧化能力强或配体的还原能力强,则发生荷移跃迁时吸收的辐射能量小、波长长。荷移跃迁的特点是跃迁概率大,吸收强度高,一般其摩尔吸光系数εmax>104,用于定量分析灵敏度高。过渡金属元素有机配合物的光度分析就是荷移跃迁光谱法的具体应用。
2.紫外光谱常用术语
生色团和助色团 分子中某一基团在一定波长范围内能产生吸收谱带,该基团就称为生色团。生色团的结构特征是含有π电子。孤立双键将在紫外区产生特征吸收带,在一般条件下显示的是没有峰形的“末端吸收”,但在真空远紫外波长下是有很强吸收峰的,一般其摩尔吸光系数εmax>104。生色团是紫外吸收光谱法的主要研究对象。(https://www.xing528.com)
在某些有机化合物中,由取代反应而引入的含义未共享电子对的杂原子基团后,例如:![]()
![]() 等,使生色团吸收峰波长向长波方向移动,吸收强度也增加,这种杂原子基团称为助色团。助色团的n电子易与生色团的π电子形成p-π超共轭,导致π→π*跃迁能量降低,使生色团的吸收波长向长波方向移动,吸收强度增加。
等,使生色团吸收峰波长向长波方向移动,吸收强度也增加,这种杂原子基团称为助色团。助色团的n电子易与生色团的π电子形成p-π超共轭,导致π→π*跃迁能量降低,使生色团的吸收波长向长波方向移动,吸收强度增加。
长移和短移(红移和蓝移) 由于化合物结构改变或溶剂改变,如果导致生色基的吸收波峰向长波(红光)方向移动的现象,称为长移,也称红移;如果导致生色基的吸收波峰向短波(蓝光)方向移动的现象,称为短移,也称蓝移。
增色效应和减色效应 由于化合物结构改变或其它外因条件改变,如果使吸收强度增强,则称为增色效应;如果使吸收强度减弱,则称为减色效应。
强带和弱带 在紫外-可见吸收光谱中,凡是摩尔吸光系数εmax>104的吸收峰称为强带;凡是摩尔吸光系数εmax<103的吸收峰称为弱带。
3.吸收谱带与分子结构的关系
在紫外-可见吸收光谱中,吸收峰的位置与强弱,与化合物的组成和结构密切相关。根据电子跃迁类型,一般把吸收带分为以下四种类型。
R带 含有杂原子的不饱和基团,由n→π*跃迁引起的吸收带,称为R带。它是基团型吸收带,吸收波长较长、吸收强度较弱(λmax~300nm、εmax<100)是其显著特点。如果化合物在溶剂极性减小时吸收峰长移(红移)、溶剂极性增大时吸收峰短移(蓝移),该吸收带就是R带,说明该化合物含有杂原子的不饱和基团。
K带 含有共轭双键的化合物,由共轭大π键的π→π*跃迁引起的吸收带,称为K带。它是共轭型吸收带,其特点是吸收强度较大,一般εmax>104,为强带;吸收波长随着共轭情况的不同而在紫外和可见光区都有分布,共轭体系越大,吸收波长越长。
B带 含有苯环(或杂芳环)的芳香族化合物,因环共轭π键的π→π*跃迁引起的吸收带,称为B带。因苯环吸收带在230~270nm的精细结构而得名(图2-9)。
B带精细结构苯蒸气紫外特征吸收光谱,蒸气状态下分子间的相互作用小,反映出孤立分子的振动-转动能级跃迁状态;在苯溶液状态下,分子间相互作用大,振动大大弱化,仅出现部分振动能级跃迁,使谱带变得较宽;在极性溶液中,溶剂和溶质间相互作用更大,振动-转动对能级跃迁的影响被湮没,因B带精细结构消失而成为一个宽而平滑的宽峰,其重心在256nm附近,ε约为200。图2-10为苯的全紫外吸收光谱。
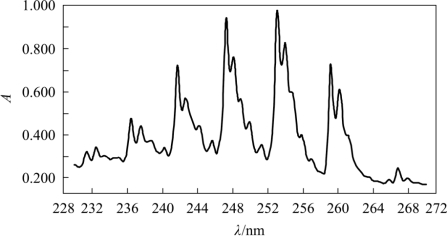
图2-9 苯蒸气紫外吸收光谱图(B带)
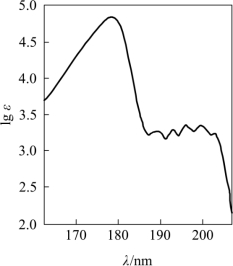
图2-10 苯的全紫外吸收光谱
E带 芳香族化合物的特征吸收带,它由苯环结构中三个双键环状共轭系统的π→π*跃迁所产生(图2-10),吸收峰λmax=177.83nm、lgεmax=4.840,属于强吸收带。
4.影响吸收带的因素
紫外光谱属于分子光谱,吸收带的位置和强度主要由分子中的生色基团所决定,受结构因素和外部测定条件的影响,致使吸收峰在一定范围内变动。结构因素对分子中电子共轭结构影响最显著,凡是使共轭效应加强的结构,其吸收峰长移、强度增强,反之则使吸收峰短移、强度减弱。
(1)共轭效应
当分子中有共轭体系时,离域的共轭π电子会组合成一组新的成键组合轨道和反键组合轨道,使组合成键轨道的最高能级略有升高、组合反键轨道的最低轨道能级略有降低,从而导致电子从成键组合轨道的最高能级跃迁到组合反键轨道的最低能级(即π→π*跃迁)的能量ΔE减小(图2-11),最大吸收波长长移,吸收强度增大。共轭体系越长,吸收波长长移越显著,甚至有长移到可见光区的,吸收峰强度增大,并出现多个吸收带(图2-12)。
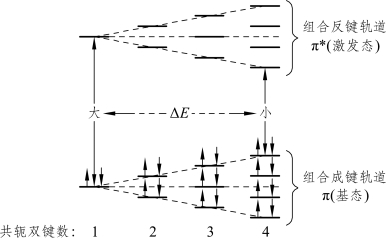
图2-11 共轭多烯线性组合轨道能级示意图
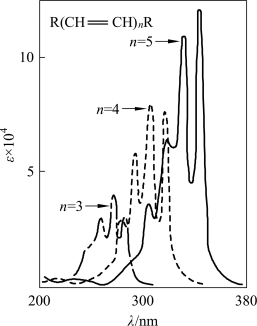
图2-12 共轭多烯的紫外吸收光谱
(2)立体效应
生色基由于取代基的空间位阻使共轭体系受到破坏,使吸收波长蓝移、吸收强度减弱,或者生色基由于立体构象、跨环的原因产生共轭效应,使吸收波长红移、吸收强度增大。这种由于立体位置的改变而使共轭减弱或形成新的微弱共轭的作用称为立体效应。
例如,二苯乙烯反式与顺式结构相比,其B带λmax长移、εmax也增加。顺式结构有立体位阻,苯环与乙烯双键不在同一平面上,整体共轭性不好(图2-13)。
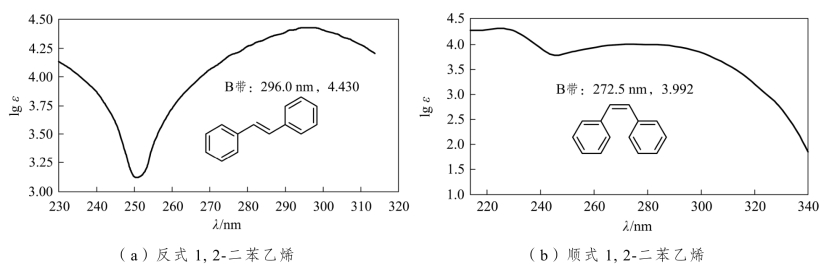
图2-13 二苯乙烯异构体的紫外吸收光谱
(3)溶剂效应
在π→π*跃迁中,激发态的极性大于基态,在极性溶剂中,极性溶剂对电荷分散体系的稳定能量使激发态和基态的能量都有所降低,但降低程度不同,激发态能级降低得稍多一些,这就导致跃迁所需能量减小,使吸收带红移;在n→π*跃迁中,激发态的极性比基态的极性小,极性溶剂体系也使两者能级均降低,但基态的能级降低得稍多一些,从而导致跃迁所需能量增加,使吸收带蓝移(图2-14)。
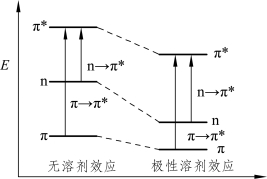
图2-14 溶剂极性对两种跃迁能量的影响
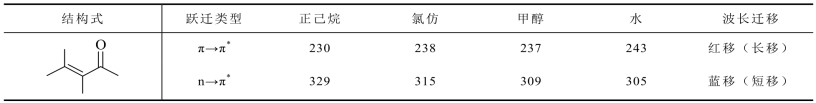
例如,溶剂极性对异亚丙基丙酮的两种跃迁产生的吸收峰的影响情况,见表2-1。
表2-1 溶剂极性对异亚丙基丙酮两种跃迁吸收峰的影响
(4)pH的影响
pH的改变对具有共轭体系的有机弱酸、弱碱、酚和烯醇的吸收峰位置有较大影响。当使共轭效应加强时,吸收谱带红移;当使共轭效应削弱时,吸收谱带蓝移。如果化合物溶液从中性变为碱性时,吸收峰发生蓝移,表明该化合物为酸性物质;如果化合物溶液从中性变为酸性时,吸收峰发生红移,表明该化合物可能为芳胺。例如:在碱性溶液中,苯酚以苯氧负离子形式存在,助色效应增强,吸收峰红移;而苯胺在酸性溶液中,![]() 以
以![]() 形式存在,p-π共轭效应被削弱,吸收峰整体蓝移、峰形分布变窄,且吸收强度减弱。
形式存在,p-π共轭效应被削弱,吸收峰整体蓝移、峰形分布变窄,且吸收强度减弱。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




