1.小量制备
方法一:煮沸法(见图3-3)
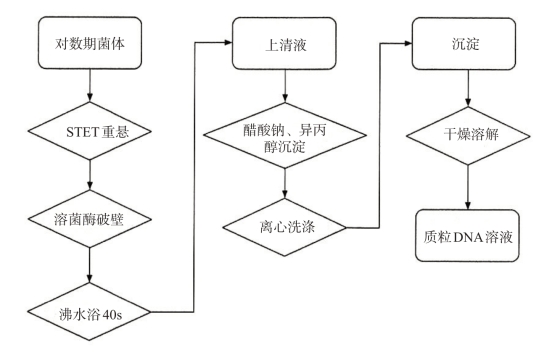
图3-3 煮沸法小量提取质粒DNA流程
(1)取1.5mL培养菌体置于EP管中,10 000 g离心1min。
(2)弃上清液,将管倒置于卫生纸上几分钟,使液体流尽。
(3)将菌体沉淀悬浮于350μLSTET溶液中,涡旋混匀。
(4)加入25μL新配制的溶菌酶溶液(10mg/mL),涡旋振荡3s混匀。(溶菌酶溶液pH值不能低于8.0,否则溶菌酶就不能有效发挥作用。)
(5)将EP管放入沸水浴中,时间恰为40 s,12 000 g,离心10min。
(6)吸出上清液移至另一个EP管,或直接用消毒牙签取出沉淀物,在上清液中加入40μL 3mol/LNaAc(pH值5.2)和420μL异丙醇,振荡混匀,室温放置5min。
(7)12 000 g,4℃离心5min,将EP管倒置于一张纸巾上,使液体流出,然后短暂离心,用移液器小心取出残液,这一步操作要格外小心,有时沉淀块贴壁不紧,将EP管放于超净工作台蒸发痕迹乙醇或放于室温直至乙醇挥发殆尽,管内无可见的液体(2~5min)。
(8)弃上清液,加入1mL 70%乙醇,12 000 g,4℃离心2min。按步骤(7)回收DNA沉淀。
(9)加入50μLTE(pH值8.0)(含无DNA酶的RNA酶20μg/mL),溶解DNA,稍加振荡,储存于20℃。
方法二:碱变性法(见图3-4)
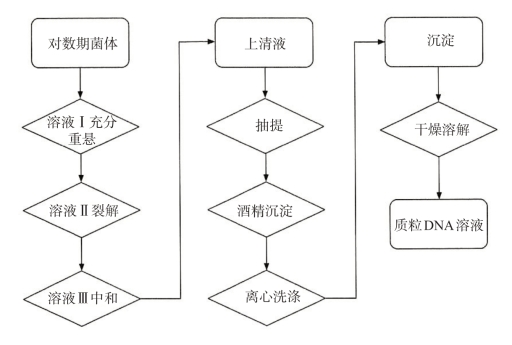
图3-4 碱法小量提取质粒DNA流程
(1)将含有质粒pBR 322的DH 5a菌种画线接种在LB固体培养基(含有100μg/mLAmp和10μg/mL的Ter)上,37℃培养12~24 h。用无菌牙签挑取单菌落接种到5mL LB液体培养基(含有100μg/mLAmp和10μg/mL的Ter)中,37℃振荡培养14~16 h。
(2)取1.5mL培养液加入1.5mLEP管中,室温12 000 r/min离心1min收集菌体(视菌体量多少,可重复此步)。
(3)加入100μL预冷的溶液上涡旋振荡悬浮菌体。
(4)加入新配制的溶液Ⅱ200μL,轻缓上下颠倒5次(动作要轻柔,千万不要振荡),至溶液澄清,冰浴5min。
(5)立即加入用冰预冷的150μL溶液Ⅲ,轻柔振荡5~10次,冰浴3~5min,12 000 r/min离心10min。
(6)取上清液移入干净EP管中,加入等体积的酚-氯仿-异戊醇(25∶24∶1),剧烈振荡20 s。室温下12 000 r/min离心5min,可见溶液分为三层,上层为质粒DNA溶液,中层为变性的蛋白层,下层为有机相。
(7)取上清液,加入等体积氯仿:异戊醇(24∶1),剧烈振荡20 s。12 000 r/min离心5min(该步骤可选做)。
(8)取上清液,加入2~2.5倍体积无水乙醇振荡混匀,沉淀DNA,-20℃放置10min(或者加l倍体积异丙醇,室温静置10min),12 000 r/min离心10min。
(9)去上清液,加入1mL 70%乙醇,12 000 r/min,2min。洗涤沉淀两次去盐。
(10)将EP管倒置于一张纸巾上,使液体流出,然后短暂离心,用移液器小心取出残液,这一步操作要格外小心,有时沉淀块贴壁不紧,将EP管放于超净工作台蒸发痕迹乙醇。(除去上清液的简便方法是用一次性使用的吸头与真空管道相连,轻缓抽吸,并用吸头接触液面。当液体从管中吸出时,尽可能使吸头远离核酸沉淀,然后继续用吸头通过抽真空除去附于管的液滴。)
(11)将沉淀溶于30μL TE缓冲液(pH值8.0,含20μg/mLRNase A)中,储于-20℃冰箱中。如直接酶切,可将沉淀溶于30~50μL ddH2O(含20μg/mLRNaseA)中。
(12)利用比色法测定质粒DNA在260 nm和280 nm下的光吸收值并计算样品浓度。
(13)用1%琼脂糖凝胶电泳观察质粒DNA的纯度和条带情况。
2.大量制备(碱裂解法,见图3-5)
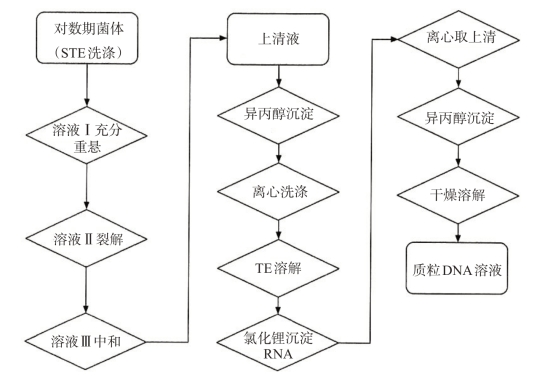
图3-5 碱法大量提取质粒DNA流程
(1)从平板上挑选一个单菌落,接种到50mL培养基上,37℃过夜培养14~16 h。
(2)将培养物转入50mLEP管,4800 r/min 4℃离心10min。
(3)沉淀用10mLSTE洗涤,涡旋混匀,4800 r/min 4℃离心10min。
(4)加入3mL溶液上,涡旋混匀,冰浴5min。
(5)加入6mL溶液Ⅱ(现配),轻柔颠倒数次直至溶液澄清,保持冰浴5min。
(6)马上加入4.5mL溶液Ⅲ,轻柔颠倒5~10次,得到白色沉淀,冰浴3~5min。
(7)4800 r/min 4℃离心20min,取上清液,加入0.6倍体积异丙醇,室温放置10min,沉淀RNA。(https://www.xing528.com)
(8)4800 r/min室温离心10min,去上清液,加入75%乙醇,洗涤沉淀。
(9)4800 r/min离心10min,去上清液,吸出痕量剩余乙醇,风干。
(10)加入1.5mLTE溶液,溶解沉淀,转入7mLEP管。
(11)加入等体积5mol/L LiCl(预冷),颠倒混匀,冰浴10min,沉淀大分子RNA。
(12)10 000 r/min 4℃离心10min,取上清液,加入等体积异丙醇,颠倒混匀,室温放置10min。
(13)10 000 r/min室温离心10min,室温放置20~30min。用700μL含无DNA酶的胰RNA酶(20μg/mL)的TE(pH值8.0)溶解沉淀,储于-20℃冰箱中。
3.质粒DNA的纯化方法
常使用的所有DNA纯化方法都利用了质粒DNA相对较小及共价闭合环状这样两个性质。例如,用氯化铯-溴化乙锭梯度平衡离心分离质粒和染色体DNA就取决于溴化乙锭(ethidiumbromide,简称EB,贮存于避光容器内,室温保存)与线状以及与闭环DNA分子的结合量有所不同。一方面,EB通过嵌入碱基之间而与DNA结合,进而使双螺旋解旋,由此导致线状DNA的长度有所增加;另一方面,EB能在闭环质粒DNA中引入超螺旋单位,使DNA超螺旋度大为增加,从而阻止EB分子的继续嵌入,但线状分子不受此限,可继续结合更多的染料,直至达到饱和(每2个碱基对大约结合1个EB分子)。由于染料的结合量有所差别,线状和闭环DNA分子在含有饱和量EB的氯化铯中的浮力密度也有所不同。多年来,氯化铯-溴化乙锭梯度平衡离心已成为制备大量质粒DNA的首选方法。然而该方法操作过程既昂贵又费时,逐渐被其他方法替代,其中最好的方法是聚乙二醇分级沉淀法,该方法最近被R.Treisman改进后可得到纯度极高的质粒。聚乙二醇分级沉淀法与氯化铯-溴化乙锭梯度平衡离心法有一点不同,那就是不能有效地把带切口的环状分子同闭环质粒DNA分开。因此纯化带切口的极大质粒(大于15 kb)时,氯化铯-溴化乙锭梯度平衡离心仍是首选的方法。
方法一:聚乙二醇沉淀法纯化质粒DNA
(1)将提取到的质粒DNA溶液转入15mLCorex管中,再加3mL用冰预冷的5mol/L LiCl溶液,充分混匀,用Sorvall SS34转头(或与其相当的转头)于4℃下以10 000 r/min离心10min。
(2)将上清液转移到另一个30mLCorex管内,加等量的异丙醇,充分混匀,用Sorvall SS34转头(或与其相当的转头)于室温以10 000 r/min离心10min,回收沉淀DNA。
(3)小心去掉上清液,敞开管口,将管倒置以使最后残留的液滴流尽。于室温用70%乙醇洗涤沉淀及管壁,流尽乙醇,用与真空装置相连的巴斯德吸管吸去附于管壁的所有液滴,敞开管口并将管倒置,在纸巾上放置几分钟,以使最后残余的痕量乙醇蒸发殆尽。
(4)用500μL无DNA酶的胰RNA酶(20μg/mL)的TE(pH值8.0)溶解沉淀,将溶液转到一微量EP管中,于室温放置30min。
(5)加入500μL含13%(W/V)聚乙二醇(PEG 8000)的1.6mol/L NaCl,充分混合,用微量离心机于4℃以12 000 g离心5min,以回收质粒DNA。
(6)吸出上清液,用400μL TE(pH值8.0)溶解质粒DNA沉淀。用酚、酚-氯仿、氯仿各抽1次。
(7)将水相转到另一微量EP管中,加入100μL 10mol/L乙醇胺,充分混匀,加2倍体积(约1mL)乙醇,室温放置10min,于4℃以12 000 g离心5min,回收沉淀的质粒DNA。
(8)吸去上清液,加500μL的70%乙醇,4℃以12 000 g离心2min。
(9)吸去上清液,敞开管口,将管置于实验桌上直到最后可见的痕量乙醇蒸发殆尽。
(10)用500μL TE(pH值8.0)溶解沉淀。l∶100稀释后测量OD260,计算质粒DNA的浓度(1OD260=50μg质粒DNA/mL),然后将DNA贮于-20℃。
方法二:氯化铯-溴化乙锭梯度平衡离心——连续梯度法
(1)测量DNA溶液的体积,按1 g/mL的用量精确地加入固体CsCl,将溶液加温至30℃助溶。温和地混匀溶液直到盐溶解。
(2)每10mLDNA溶液加入0.8mL溴化乙锭溶液(10mg/mL溶于水);立即将溴化乙锭溶液(漂浮在表层)与RNA-氯化铯溶液混匀,溶液的终密度应为1.55 g/mL(溶液的折射率为1.3860),溴化乙锭浓度大约740μg/mL。
(3)室温下用Sorvall SS34转头(或与其相当的转头)以8000 r/min离心5min,浮在溶液上面的水垢状浮渣是EB和细菌蛋白所形成的复合物。
(4)用巴斯德吸管或带大号针头的一次性注射器将浮渣下的清亮红色溶液转移到EP管中。用轻液状石蜡加满管的其余部分并封口。
(5)以20℃对所得的密度梯度以45 000 r/min离心16 h(VTi65转头)、以45 000 r/min离心48 h(Ti50转头)、以60 000 r/min离心24 h(Ti65转头),或者以60 000 r/min离心24 h(Ti70.1转头)。普通光照下,在梯度中心可见两条DNA区带,上部区带材料通常较少,由线状的细菌(染色体)DNA和带切口的环状质粒DNA组成;下部区带则由闭环质粒DNA组成。管底部深红色的沉淀是溴化乙锭-RNA复合物,位于CsCl溶液和液状石蜡之间的是蛋白质。Beckman QLlick-Sea.1 EP管中的CsCl-溴化乙锭梯度可容纳4mg闭环质粒DNA而不至超负荷。如有更大量的质粒存在,将扩展为一条宽带,并与染色体DNA相重叠。这种问题只有在质粒复制达到极高水平时才会出现,只要将该质粒提取物分为两个梯度即可解决。如出现超负荷,可收集整个DNA区带,用CsCl溶液(ρ=1.58 g/mL)将体积调到15mL,在两个EP管中再度离心,使DNA达到平衡。
(6)收集DNA带,将21号皮下注射针头插入管的顶端以使空气进入,为尽量减少污染的机会,首先用18号皮下注射针头按下述方法收集上部的区带(染色体DNA):用乙醇小心擦拭管外壁以除去任何油脂,然后将一块Soctch胶带贴于管外壁。穿过Soctch胶带将18号皮下注射针头(其斜面向上)插入管中,以便使针头的斜面开口恰好位于染色体DNA区带之下并与该区带相平行。将黏稠状DNA收集到一次性使用的管内,用造型黏土块封住皮下注射针头的末端并将第2根针头留于原处。穿过Soctch胶带插入第3根皮下注射针头(18号),将下部的质粒DNA区带收集到玻璃或塑料管中。
方法三:氯化铯-溴化乙锭梯度平衡离心——不连续梯度法
该方法是将含不同浓度CsCl的溶液分层加到EP管中,这样可以加速CsCl梯度的形成,使离心时间减少到6 h。
(1)将125 g CsCl加到167mL(pH值8.0)中,制成CsCl溶液(ρ=1.47 g/mL)。
(2)将8mL氯化铯溶液加到Beckman QlJick-Seal EP管(或与其相当的管)中,待用。
(3)用TE(pH值8.0)将质粒DNA溶液的体积精确地调到3mL。
(4)在质粒DNA溶液中加入8.4 g CsCl,将溶液加温至30℃以促进盐溶解,小心地混匀溶液直至盐溶解。
(5)称量溶液重量并加入TE(pH值8.0)直到溶液重量恰好达13.2 g,用天平称量时应注意去除管的重量。
(6)加入0.8mLEB溶液(10mg/mL溶于水),快速混匀溶液直至染料均匀地分散,此时溶液体积应大约为7.5mL。
(7)室温下,用Sorvall SS34转头(或与之相当的转头)以8000 r/min离心5min,浮在液面上的水垢状浮渣是EB和细菌蛋白所形成的复合物。
(8)将22.86 cm的巴斯德吸管放入装有CsCl的EP管中,吸头应接触管底。用吸管小心地将制备好的清亮红色溶液(来自浮渣之下)加入管内,使样本层位于CsCl溶液(1.47 g/mL)之下。如有必要,可酌情将CsCl溶液(ρ=1.47 g/mL)添满EP管,封口。
(9)将封口的管(与相应的平衡管一起)放入Beckman Ti70.1或Sorvall65.13转头(或与之相当的转头)中于20℃以60 000 r/min离心6 h。
(10)回收闭环质粒DNA区带。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




