配离子的配位离解平衡也是一定条件下的相对的平衡状态,当条件改变时,也有平衡发生移动的问题。下面讨论不同情况下配离子的配位离解平衡的移动及有关计算问题。
1.改变溶液的pH
许多配体(如F-、CN-、SCN-、NH3等)及有机酸根离子,都能与H+结合,形成难离解的弱酸,所以当溶液的pH 改变时,可能会引起某些配离子的配位离解平衡的移动。
例如,在弱酸介质中,Fe3+与F-配位生成[FeF6]3-,即
平衡后,向溶液中加入浓度为6 mol·L-1的HCl 溶液,降低溶液的pH,则会促使式(8.2)的平衡向右移动。F-的浓度由于HF 的生成而降低,进而又促使式(8.1)的平衡向右移动。pH 越低,F-浓度降低得越多,足量的HCl 可使[FeF6]3-配离子完全离解。
如果向式(8.1)平衡溶液加入NaOH 溶液,提高溶液的pH,由于Fe3+的水解度增大而使其浓度降低,也会使式(8.1)的平衡向右移动。pH 越高,Fe3+水解程度越高,当pH 升高到一定值时,Fe3+由于生成难溶的Fe(OH)3沉淀而使配离子完全离解。
又如,往[Ag(NH3)2]+的溶液中加入硝酸以降低溶液的pH 时,由于NH3与H+结合生成NH4+,使式(8.3)的平衡向配离子离解的方向移动。当硝酸加到足够量时,配离子则会完全离解。如果初始时溶质是[Ag(NH3)2]Cl,则此时溶液中会出现白色AgCl 沉淀。
根据式(8.3)和式(8.4)得总平衡方程式为
由平衡常数可知反应向右进行的趋势非常大,因此用酸可以有效地使以NH3为配体的配离子离解。
【例题8.4】向浓度为0.20 mol·L-1的[Cu(NH3)4]2+溶液中加入等体积的浓度为2.0 mol·L-1的HNO3溶液,求最后平衡时,溶液中[Cu(NH3)4]2+配离子的浓度。
解:依题意有
由于溶液等体积混合,因此浓度减半,则有[Cu(NH3)42+]始=0.1 mol·L-1,[HNO3]始=1.0 mol·L-1。由平衡化学反应方程式知,H+过量,故可认为[Cu(NH3)2]2+完全离解,生成0.1 mol·L-1的Cu2+和0.4 mol·L-1的NH4+,同时消耗0.4 mol·L-1的H+。由于[Cu(NH3)4]2+、Cu2+之间还存在着配位离解平衡,故可设平衡时溶液中[Cu(NH3)4]2+浓度为x mol·L-1,则有
平衡浓度/(mol·L-1): x 0.60 0.10 0.40
解得:x=7.5×10-27mol·L-1
2.加入另一种配体
当向某种配离子的溶液中加入另一种能同中心离子配位形成更稳定的配离子的配体时,原来的配离子的平衡将被破坏,并转变成更稳定的配离子。例如,向[Ag(NH3)2]+溶液中,加入KCN 溶液。溶液中存在下列两个过程:
根据式(8.5)和式(8.6)得总平衡方程式为
Kθ值较大,说明式(8.7)的反应进行得较彻底,即[Ag(NH3)2]+转化成[Ag(CN)2]-的反应进行得相当彻底。随着KCN 溶液的加入,[Ag(NH3)2]+逐渐离解,最后生成更加稳定的[Ag(CN)2]-。
【例题8.5】在1.0 L 浓度为0.10 mol·L-1的[Ag(NH3)2]+溶液中,加入0.20 mol KCN 晶体(忽略体积变化),求平衡时溶液中[Ag(NH3)2]+与[Ag(CN)2]-的浓度。
解:对于反应:
由于平衡常数较大,说明[Ag(NH3)2]+转化为[Ag(CN)2]-较彻底,因此可假定0.10 mol·L-1的[Ag(NH3)2]+因存在足量CN-而全部转化为[Ag(CN)2]-,则消耗的CN-浓度为0.20 mol·L-1,生成时的NH3浓度为0.20 mol·L-1。但在[Ag(NH3)2]+与Ag+、NH3之间,[Ag(CN)2]-与Ag+、CN-之间还存在着配位离解平衡,则可设溶液中[Ag(NH3)2]+浓度为x mol·L-1,则平衡时有
由平衡化学反应方程式[Ag(NH3)2]++2CN-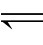

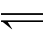 [Ag(CN)2]-+2NH3,可得(https://www.xing528.com)
[Ag(CN)2]-+2NH3,可得(https://www.xing528.com)
因此,平衡时溶液中[Ag(NH3)2]+浓度为2.6×10-6mol·L-1,[Ag(CN)2]-浓度为0.10 mol·L-1。
3.加入沉淀剂
一些难溶盐往往因形成可溶性的配合物而溶解,如将AgNO3和NaCl 溶液混合,则有白色AgCl 沉淀生成,加入氨水后,AgCl 沉淀消失,生成可溶的[Ag(NH3)2]+配离子。然而,继续加入KBr 溶液后,又会生成淡黄色的AgBr 沉淀;再加入Na2S2O3溶液,AgBr 沉淀又溶解,生成[Ag(S2O3)2]3-配离子;接着又加入KI 溶液,则有黄色AgI 沉淀生成;再加入KCN 溶液,黄色AgI 沉淀又消失而生成[Ag(CN)2]-配离子;若再加入Na2S 溶液,则有黑色Ag2S 沉淀生成。
由上述可知,当配合剂的配合能力大于沉淀剂的沉淀能力时,沉淀则溶解,生成可溶性配合物;反之,沉淀剂的沉淀能力大于配合剂的配合能力,则配合物被破坏,生成新的沉淀。
【例题8.6】1.0 L 浓度为0.10 mol·L-1的[Ag(NH3)2]+溶液中,游离NH3的浓度为1.0 mol·L-1,加入0.10 mol KI 固体(忽略体积变化),求平衡时[Ag(NH3)2]+的浓度。
解:溶液中存在两个过程:
将上两式相加即得体系总平衡化学反应方程式:
由多重平衡原则有:
由Kθ值较大可知,反应向右进行的趋势很大,故可假设[Ag(NH3)2]+全部转化为AgI,则产生的NH3为0.20 mol,消耗的I-为0.1 mol,但[Ag(NH3)2]+与Ag+、NH3,AgI与I-、Ag+之间毕竟还存在着平衡关系,故可设整个体系达平衡时Ag(NH3)2+的浓度为x mol·L-1,则有
因此 ,即[Ag(NH3)2]+浓度为6.1×105mol·L-1。
,即[Ag(NH3)2]+浓度为6.1×105mol·L-1。
【例题8.7】1.0 L 浓度为1.0 mol·L-1的KCN 溶液中可溶解多少AgI 沉淀(单位为mol)?
解:设1.0 L 浓度为1.0 mol·L-1的KCN 溶液中可溶解x mol 的AgI 沉淀,则有
平衡浓度/(mol·L-1): 1.0-2x x x
即
【例题8.8】1.0 L 氨水正好溶解了0.10 mol 的AgCl 沉淀,计算氨水的初始浓度。
解:设平衡时溶液中游离氨为x mol·L-1,则有
平衡浓度/(mol·L-1): x 0.10 0.10
氨的初始浓度为:[NH3]+2[Ag(NH3)2+]=(1.92+2×0.10)mol·L-1=2.12 mol·L-1
3.加入氧化剂或还原剂
如果向配离子的溶液中加入能与中心离子或配体反应的氧化剂或还原剂,也会使配离子的配位离解平衡发生移动。
例如,向[Ag(CN)2]-溶液中加入锌粉,由于Ag+被Zn 还原成单质Ag,而使[Ag(CN)2]-配离子向离解的方向移动,最后完全离解。即
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




