1.沉淀的生成
根据溶度积规则,在难溶强电解质的溶液中,若Qi>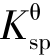 ,则可以生成沉淀。
,则可以生成沉淀。
1)加入沉淀剂
在含有某种离子的溶液中,加入某种沉淀剂,可与该离子生成难溶物。
【例题4.18】向30 mL 浓度为0.020 mol·L-1的Na2SO4溶液中加入同体积等浓度的BaCl2溶液,问有无沉淀生成?已知![]() 。
。
解:混合后,溶液中Ba2+、SO2-4 离子的浓度为
根据溶度积规则,有BaSO4沉淀生成。
【例题4.19】0.30 mol·L-1的HCl 溶液中含有少量的Cd2+离子,当向溶液中通入H2S达饱和时(饱和H2S 水溶液浓度为0.1 mol·L-1),问Cd2+离子能否沉淀完全?若将Cd2+改为Zn2+离子,则Zn2+离子能否沉淀完全?已知![]() ,
,![]() 。
。
解:在0.30 mol·L-1的HCl 溶液中,H2S 的电离平衡为
根据溶度积规则,平衡时有
结果说明溶液中Cd2+离子已沉淀完全。
注意:无机化学中规定,通过沉淀方法使溶液中某离子的浓度小于或等于1.0×10-5mol·L-1时,可以认为该离子已沉淀完全。
如将Cd2+离子改为Zn2+离子,则有
因此Zn2+离子不能沉淀完全。
【例题4.20】在1 L 含有0.001 mol SO42-的溶液中,加入0.01 mol BaCl2晶体,能否使![]() 沉淀完全?已知
沉淀完全?已知![]() 。
。
解:根据题意,[Ba2+]=0.01 mol·L-1,![]() ,平衡时Ba2+离子的浓度是BaCl2起始浓度减去与SO42-离子反应而消耗的Ba2+浓度并加上生成0.001 mol·L-1BaSO4沉淀电离出的极少的Ba2+浓度。但由于BaSO4的溶度积很小,所以BaSO4电离出的Ba2+浓度可以忽略不计,则有
,平衡时Ba2+离子的浓度是BaCl2起始浓度减去与SO42-离子反应而消耗的Ba2+浓度并加上生成0.001 mol·L-1BaSO4沉淀电离出的极少的Ba2+浓度。但由于BaSO4的溶度积很小,所以BaSO4电离出的Ba2+浓度可以忽略不计,则有
故可认为溶液中的SO4
2-离子沉淀完全。
2)控制溶液的pH
某些难溶的弱酸盐和难溶的氢氧化物,通过控制溶液的pH,可以使其沉淀(或溶解)。
【例题4.21】计算欲使浓度为0.01 mol·L-1的Fe3+开始沉淀和沉淀完全时的pH。已知![]() 。
。
解:(1)开始沉淀时所需pH。依题意有
(2)沉淀完全时所需pH。依题意可知,当[Fe3+]≤1.0×10-5mol·L-1时,Fe3+可视为沉淀完全。于是有
通过此例的计算可看出:
①氢氧化物开始沉淀和沉淀完全不一定在碱性环境中;
②不同难溶氢氧化物的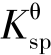 不同,化学反应方程式不同,它们沉淀所需的pH 也不同,故可通过控制pH 达到分离金属离子的目的。当然,上述计算仅仅是理论值,实际情况往往复杂得多。
不同,化学反应方程式不同,它们沉淀所需的pH 也不同,故可通过控制pH 达到分离金属离子的目的。当然,上述计算仅仅是理论值,实际情况往往复杂得多。
2.分步沉淀
在溶液中常常含有多种离子,当加入某种沉淀剂时,往往可以和多种离子生成难溶电解质。在这种情况下,离子的沉淀按什么顺序进行?接下来我们根据溶度积原理进行一定的计算以求得明确的答案。
【例题4.22】在含有0.01 mol·L-1的Cl-和I-的溶液中,逐滴加入AgNO3溶液,问:
(1)AgCl 和AgI 哪个先析出?
(2)当后沉淀的离子开始生成沉淀时,先析出沉淀的离子是否已沉淀完全?
已知298.15 K 时。
解:(1)根据溶度积规则,可算出生成AgCl 和AgI 所需的最低Ag+浓度。(https://www.xing528.com)
①AgCl 开始沉淀所需的最低Ag+浓度为
②AgI 开始沉淀所需的最低Ag+浓度为:
计算结果表明,沉淀I-所需要的Ag+浓度比沉淀Cl-所需要的Ag+浓度小得多,所以AgI 先析出。
(2)当AgCl 开始沉淀时,溶液中[Ag+]≥1.77×10-8mol·L-3,此时溶液中残留的I-浓度为
[I-]=![]() 因此当Cl-开始生成沉淀时,I-已沉淀完全了。
因此当Cl-开始生成沉淀时,I-已沉淀完全了。
【例题4.23】若溶液中Fe3+和Mg2+的浓度都是0.10 mol·L-1,加入氢氧化钠溶液(忽略溶液体积变化),欲使Fe3+沉淀完全而Mg2+不生成沉淀,应将溶液的pH 控制在什么范围?已知。
解:Fe3+离子沉淀完全时,溶液中OH-浓度为
Mg2+离子开始沉淀时,溶液中OH-浓度为
因此,把pH 控制在2.81~8.87 之间,就可使Fe3+沉淀完全,而Mg2+不生成沉淀仍留在溶液中,达到分离的目的。
利用分步沉淀原理,可使两种离子分离,而且两种沉淀的溶度积相差越大,分离就越完全。沉淀的先后次序,除与溶度积有关外,还与溶液中被沉淀离子的最初浓度有关。若溶液中有两种离子都能与沉淀剂生成沉淀物质,其中一种与沉淀剂生成的化合物溶度积虽然较大,但该离子在溶液中有较大的浓度,使其离子浓度乘积首先达到溶度积,则这种离子将首先沉淀。总之,分步沉淀的顺序并不是固定的,其决定因素是:沉淀物质的溶度积与被沉淀离子的浓度。
3.沉淀的转化
有些沉淀不能利用酸碱反应、氧化还原反应和配位反应直接溶解,但可以将其转化为另一种沉淀溶解,这种由一种沉淀转化为另一种沉淀的过程称为沉淀的转化。
例如,锅炉中的锅垢的主要成分为CaSO4,由于锅垢的导热能力很小,阻碍传热,浪费燃料,还可能引起锅炉或蒸气管爆裂等事故,所以必须清除。但CaSO4不溶于水也不溶于酸,很难清除。此时若用溶液处理,则可使CaSO4转化为疏松且可溶于酸的CaCO3而除去。CaSO4转化为CaCO3的反应如下:
总反应为
总反应平衡常数为
沉淀转化反应的Kθ很大,说明反应向右的趋势很大,即CaSO4转化为CaCO3程度很大。应该指出,沉淀的转化是有条件的,由一种难溶电解质转化为另一种更难溶电解质是比较容易的,反之则比较困难,甚至不可能转化。
例如,AgCl 的溶度积比AgI 的溶度积大很多(10-17),因此要把AgCl 转化为AgI 非常容易,相反要把AgI 转化为AgCl 则非常困难,这一点从转化反应的平衡常数也可看出,即
由于平衡常数非常小,因此实际上反应不能向右进行,实现转化也就不太可能。
总而言之,如果转化反应的平衡常数较大,转化就比较容易实现;如果转化反应平衡常数很小,则不可能转化;某些转化反应的平衡常数既不很大,又不很小,则在一定条件下转化也是可能的。
【例题4.24】通过计算说明,用1 L 浓度为多少的Na2CO3溶液才能将0.10 mol 的CaSO4沉淀转化为CaCO3沉淀?已知。
解:
反应的平衡常数很大,可见沉淀转化相当完全。因此,欲使0.10 mol 的CaSO4沉淀完全转化为CaCO3沉淀,所需Na2CO3的初始浓度也就是0.10 mol·L-1。
4.沉淀的溶解
根据溶度积规则,要使沉淀溶解,必须降低溶液中的某种离子浓度,使Qi<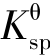 ,常用的方法有以下几种。
,常用的方法有以下几种。
1)生成弱电解质
(1)生成弱酸,如CaCO3、ZnS、FeS 等,都可以溶解于稀盐酸中,原因就是难溶盐的阴离子生成了弱酸。例如:
(2)生成弱碱,如氢氧化镁可以溶解于氯化铵中,原因就是生成了弱碱氨水,即
(3)生成水。所有难溶的金属氢氧化物在强酸性溶液中都有不同程度的溶解,原因是弱电解质水的生成。例如:
2)发生氧化还原反应
例如,金属硫化物的溶解:MnS、ZnS、FeS 可以溶于稀盐酸;SnS、PbS 可以溶于浓盐酸;CuS、Ag2S 不溶于盐酸,但可以溶于硝酸中;而HgS 虽不溶于硝酸却能溶于王水中。即
3)生成配位化合物
例如,HgI2可以溶于KI 溶液,HgS 可以溶于Na2S 溶液,AgCl、Cu(OH)2可以溶于氨水。即
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




