用pH 试纸分别测定相同浓度的NaCl、CH3COONa、(NH4)2SO4溶液的pH,结果显示:NaCl 溶液的pH=7,显中性;CH3COONa 溶液的pH>7,显碱性;(NH4)2SO4溶液的pH<7,显酸性。CH3COONa 和(NH4)2SO4本身并不能电离出OH-、H+,但其水溶液却分别显示出碱性、酸性,这是由于盐的阴离子、阳离子与水解离出的H+、OH-结合生成弱电解质——弱酸、弱碱,使水的电离平衡发生移动,导致溶液中H+和OH-的浓度不相等,从而表现出酸碱性。盐电离出的离子与水电离出的H+或OH-结合生成弱酸或弱碱,从而使溶液的酸碱性发生改变的反应,称为盐的水解反应。
1.一元弱酸强碱盐的水解
以CH3COONa 的水解为例,溶液中存在下列平衡:
总反应为
水解常数为
【例题4.11】计算298 K 时,0.10 mol·L-1的CH3COONa 水溶液的pH 和CH3COONa的水解度h(已知CH3COOH 的 =1.74×10-5)。
=1.74×10-5)。
解:由题可知
由于 ,可以用近似计算公式计算,即
,可以用近似计算公式计算,即
2.一元弱碱强酸盐的水解
以NH4Cl 的水解为例,溶液中存在下列平衡:
总反应为
水解常数为
同样,当 时,。
时,。
3.一元弱酸弱碱盐的水解
以CH3COONH4溶液为例,水解反应方程式为:
水解常数为
但如何判断溶液的酸碱性呢?
在CH3COONH4溶液中存在如下平衡:
在这些反应平衡中,有的生成物得到了质子,有的生成物失去了质子,得到质子的生成物有H+和CH3COOH,失去质子的生成物有OH-和NH3·H2O,质子的得失应该相等,即在溶液中应存在质子(得失)平衡,即
其中
将以上三式代入式(4.14)得
整理得
式(4.15)是一元弱酸弱碱盐水溶液中[H+]的精确计算公式。当[NH4+]不太小时,有![]() ·
·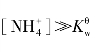 ;当[CH3COO-]不太小时,有
;当[CH3COO-]不太小时,有 ,则
,则
水解前,溶液中[CH3COO-]=[NH4+],若水解后[CH3COO-]≈[NH4+],则
式(4.16)是一元弱酸弱碱盐水溶液中[H+]的近似计算公式。由此式可得到一元弱酸弱碱盐水溶液的pH 计算公式,即
由式(4.17)可知:
(1)当![]() 时,溶液呈酸性;
时,溶液呈酸性;
(2)当![]() 时,溶液呈碱性;
时,溶液呈碱性;
(3)当![]() 时,溶液呈中性。
时,溶液呈中性。
【例题4.12】计算0.10 mol·L-1NH4的CN 溶液的pH,各组分浓度及水解度。已知![]() 。
。
解:利用一元弱酸弱碱盐水溶液中[H+]的近似计算公式,可得(https://www.xing528.com)
设平衡时,NH3·H2O 浓度为x mol·L-1,HCN 浓度为y mol·L-1,则
结果表明,近似计算的假设([NH3·H2O]=[HCN])完全合理,相对误差只有0.4%。盐的水解度应以水解程度小的离子为准进行计算,结果为
4.多元弱酸强碱盐的水解
以Na2S 的水解为例,水解平衡与水解常数为
当![]() 时,
时,![]() ,计算溶液pH 及水解度时,可以只考虑第一步水解。
,计算溶液pH 及水解度时,可以只考虑第一步水解。
【例题4.13】计算0.10 mol·L-1的Na2S 溶液的[S2-]、pH、其他组分的浓度及其水解度。已知![]() 。
。
解:Na2S 水解常数分别为
由于![]() ,因此,在计算溶液pH 时,可以只考虑第一步水解;又因为
,因此,在计算溶液pH 时,可以只考虑第一步水解;又因为![]() 远远小于400,所以,不能用近似计算公式。设平衡时溶液中[HS-]=x mol·L-1,则有
远远小于400,所以,不能用近似计算公式。设平衡时溶液中[HS-]=x mol·L-1,则有
解得x=0.098 8 mol·L-1,即[HS-]=[OH-]=0.098 8 mol·L-1;
则有pH=14.0-pOH=14.0+lg[OH-]=14.0+lg 0.098 8=13.00。
考虑第二步水解,则有
由于[HS-]=[OH-]=0.098 8 mol·L-1,所以[H2S]≈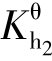 =1.75×10-7mol·L-1,溶液中其他组分的浓度分别为:[Na+]=0.20 mol·L-1,[H+]=1.0×10-13mol·L-1,[S2-]=0.001 2 mol·L-1,Na2S 的水解度h=99%。
=1.75×10-7mol·L-1,溶液中其他组分的浓度分别为:[Na+]=0.20 mol·L-1,[H+]=1.0×10-13mol·L-1,[S2-]=0.001 2 mol·L-1,Na2S 的水解度h=99%。
5.多元弱酸酸式盐的水解
以NaHCO3水溶液为例,在溶液中存在下列平衡:
根据质子平衡可得
其中
将以上三式代入式(4.18),得
整理得
同样,当 (20 倍以上)时,溶液中[H+]的近似计算公式为
(20 倍以上)时,溶液中[H+]的近似计算公式为
【例题4.14】计算0.050 mol·L-1的NaHCO3溶液的pH。已知H2CO3的 =4.3×10-7,
=4.3×10-7,![]() 。
。
解:0.050 mol·L-1NaHCO3溶液的浓度不算小,可以用近似计算公式,则
6.影响盐类水解的因素
影响盐类水解的因素主要是外界因素,不考虑盐自身组成的影响。
1)盐浓度的影响
从盐浓度与水解度的关系 可知,盐溶液浓度越小,水解越强。例如,SbCl3和SnCl2水溶液稀释时,水解生成SbOCl 和Sn(OH)Cl 白色沉淀。
可知,盐溶液浓度越小,水解越强。例如,SbCl3和SnCl2水溶液稀释时,水解生成SbOCl 和Sn(OH)Cl 白色沉淀。
2)温度的影响
盐类水解是酸碱中和反应的逆反应,酸碱中和反应放热,因此盐类水解反应吸热。温度升高,盐类水解加强。例如,Fe(NO3)3溶液受到加热时,Fe3+水解加强,溶液颜色逐渐加深。
3)溶液酸碱度的影响
由于盐类水解会改变溶液的酸碱性,因此溶液的酸碱度反过来会直接影响盐类水解的程度。但因为不同的盐水解结果不同,所以溶液酸碱度对其影响也不同。例如
对于前一反应,溶液酸度增大,水解减弱;对于后一反应,溶液酸度增大,水解加强。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




