1.胎盘间充质干细胞概述
胎盘间充质干细胞是从胎盘组织中分离提取的间充质干细胞(图2-2-9),它来源于发育早期的中胚层和外胚层,在适宜的体内或体外环境下间充质干细胞可以分化为中胚层的间质组织,还保持有内胚层的分化潜能,可分化为神经细胞、上皮细胞、心肌细胞以及成骨细胞等。国际细胞治疗学会(ISCT)界定MSC的基本标准:①贴壁生长;②表型特征(≥95%的细胞,表达CD105、CD73、CD90;大多数不表达CD45、CD34、CD14、CD19等,不表达MHCⅡ类分子,如HLA-DR抗原等)(图2-2-10);③可分化成为成骨细胞、脂肪细胞、成软骨细胞(图2-2-11)。
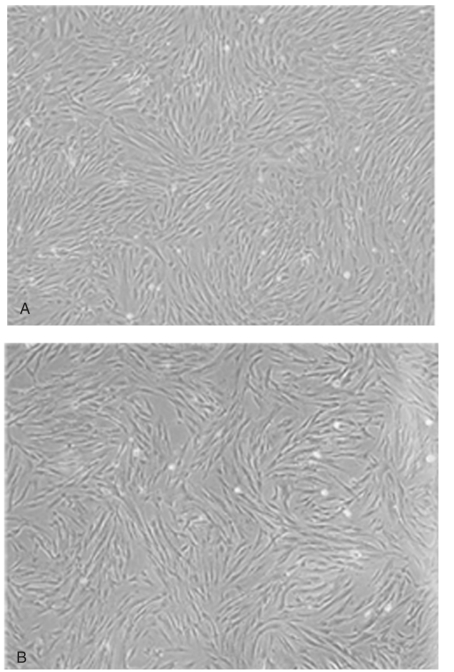
图2-2-9 胎盘间充质干细胞的形态观察。
(A)原代培养7d的胎盘间充质干细胞;(B)传代培养21d的胎盘间充质干细胞[1]。
2.胎盘间充质干细胞的优势
造血支持:胎盘间充质干细胞可表达多种造血相关因子,可促进造血CD34+细胞增殖。
免疫调控:胎盘间充质干细胞具有低免疫原性,与同种异体人外周血单个核细胞共培养,无刺激细胞增殖的现象,并通过非直接接触的作用方式抑制人同种异体混合淋巴细胞反应。
3.胎盘间充质干细胞的作用机制(图2-2-12)
胎盘间充质干细胞可表达多种造血相关因子,例如IL-6、IL-7、IL-8、IL-11、IL-12、IL-14、IL-15、M-CSF、FLt-3L和干细胞生长因子(SCF)等,对各系血细胞在不同时期的发育和成熟都起着重要的作用。以胎盘间充质干细胞为滋养层,可显著地扩增造血干细胞(造血CD34+细胞)、集落形成细胞(CFC)和长期培养启动细胞(LTC-IC)。
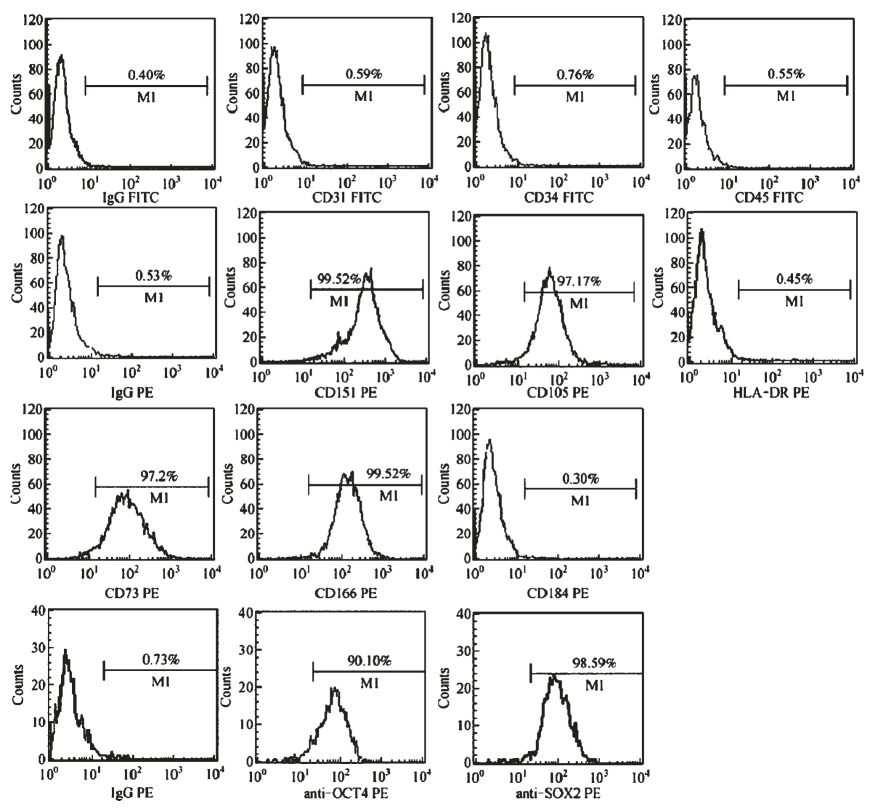
图2-2-10 胎盘间充质干细胞的免疫分型[2]。
胎盘间充质干细胞在移植免疫耐受、自身免疫、肿瘤免疫和胎儿母体免疫耐受中都具有重要的调节作用。胎盘间充质干细胞与T细胞、抗原提呈细胞(APC细胞)、B细胞和自然杀伤细胞(NK细胞)都有免疫抑制作用。在特定的微环境下间充质干细胞对活化T细胞的增殖有着抑制的作用,间充质干细胞通过分泌PGE-2、TGF-β等发挥抑制功能。间充质干细胞能够诱导CD4+CD25+FOXP3+调节性T细胞分泌IL-10、TGF-β、IDO等达到抑制T细胞的增殖作用。间充质干细胞还能通过抑制IL-2、IL-15的分泌减少NK细胞的增殖和IFN-γ的生成,从而抑制NK杀伤细胞的作用。
4.胎盘间充质干细胞的适应证
间充质干细胞可用于修复受伤或病变的多种组织器官,可治疗心脑血管疾病、神经系统疾病、肝脏疾病、内分泌疾病、自身免疫系统疾病等多种疾病,单独使用可治疗细胞或器官移植后免疫排斥反应,提高移植成功率。
 骨组织工程:骨缺损、软骨损伤、肌腱损伤。
骨组织工程:骨缺损、软骨损伤、肌腱损伤。
 神经系统:神经管发育畸形、缺氧缺血性脑病、帕金森病。
神经系统:神经管发育畸形、缺氧缺血性脑病、帕金森病。
 心血管疾病:心肌缺血、心肌梗死。
心血管疾病:心肌缺血、心肌梗死。
 肝损伤、肺纤维化、肺损伤。
肝损伤、肺纤维化、肺损伤。
 创面修复。
创面修复。
5.临床应用案例简介
(1)Ⅰ型糖尿病和Ⅱ型糖尿病

图2-2-11 间充质干细胞的分化能力[4]。
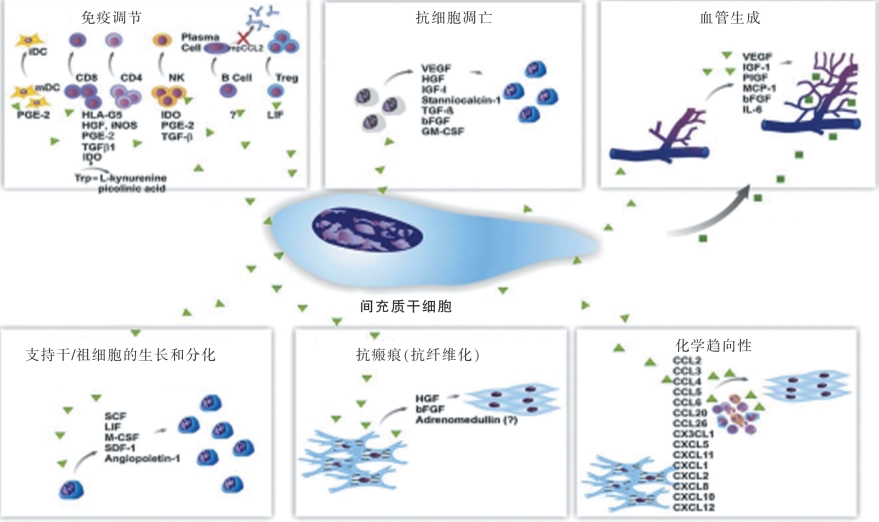
图2-2-12 胎盘间充质干细胞的作用机制[3]。
2011年,辽阳糖尿病医院与北京汉氏联合生物技术有限公司的首席科学家韩忠朝教授合作开展了“胎盘间充质干细胞移植治疗Ⅱ型糖尿病”的临床研究,使用胎盘间充质干细胞治疗Ⅱ型糖尿病,每日胰岛素用量减少1/2(表2-2-2),从而减少了注射胰岛素带来的生活不便和注射疼痛。代表胰腺细胞功能恢复的C肽水平显著升高,同时患者体内胰岛素含量显著性上升(表2-2-3),说明胎盘间充质干细胞可以恢复胰腺细胞的功能。一例足部出现溃疡和坏疽的患者,经胎盘间充质干细胞治疗,3个月后溃疡完全愈合(图2-2-13)。
进行了胎盘干细胞移植的患者无发热、寒战、肝功能损伤等副作用,并且输注后肾功能和心脏功能得到改善。提示胎盘干细胞移植是一种安全、有效的治疗Ⅱ型糖尿病胰岛功能障碍的方法。
根据已有的文献报道,干细胞治疗糖尿病的原理大概有如下几个方面:①干细胞定植于胰腺受损部位诱导分化成胰岛β细胞;②干细胞分泌的因子对损伤的胰岛β细胞修复起到重要作用;③干细胞降低胰岛素抵抗的作用;④干细胞的免疫调控作用;⑤部分干细胞分化血管内皮细胞,改善胰腺血液供应。
(2)下肢缺血症
下肢血管病主要是由于各种原因导致血管的狭窄闭塞,组织缺血、缺氧而表现为溃疡、坏疽等一系列症状的疾病,包括血栓闭塞性脉管炎、动脉硬化性闭塞症、多发性动脉炎、糖尿病足等。
体内、外的实验证明,多种干细胞,包括造血干细胞、间充质干细胞和内皮祖细胞等,能够促进血管再生和血管侧支的形成。
李国剑等[5]使用自体外周血干细胞移植治疗50例(62条患肢)血栓闭塞性脉管炎,移植后3个月,10例(10条患肢)溃疡全部愈合;46例保肢患者,移植后其间歇性跛行距离增加、下肢皮温增加、踝肱指数增加,三项指标均明显优于移植前(P<0.05)。移植后6个月,对46例保肢患者的58条患肢行动脉造影,结果显示均有不同程度的新生侧支血管形成。这说明自体外周血干细胞移植治疗血栓闭塞性脉管炎是一种简单、安全、有效的方法。
表2-2-2 干细胞移植前后患者胰岛素用量[2](*P<0.01)
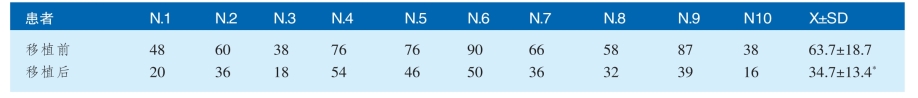
表2-2-3 干细胞移植前后患者胰岛素水平[2](n=10,*P<0.01)


图2-2-13 使用间充质干细胞治疗糖尿病足前后比较。
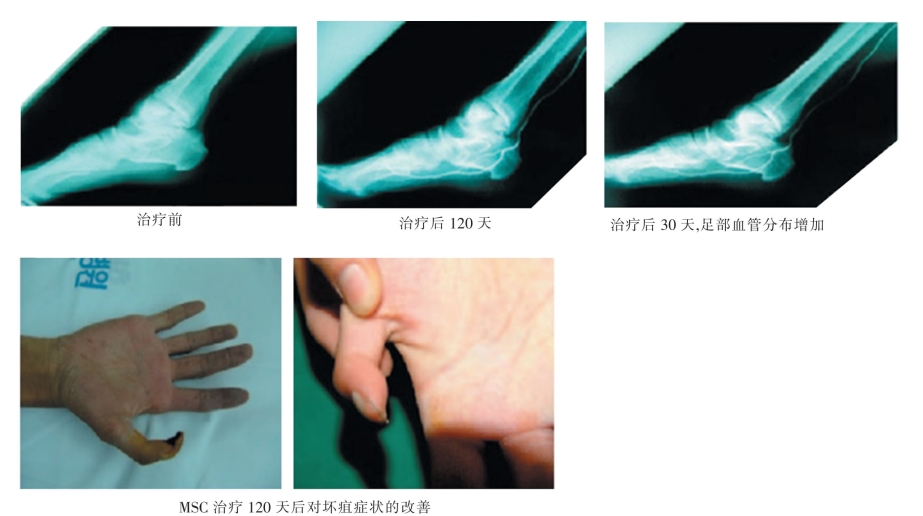
图2-2-14 脐带来源的MSC对Buerger缺血性症状的改善[6]。
Kim[6]发现,脐血来源的间充质干细胞对Buerger患者的下肢缺血症状有明显的改善(图2-2-14),并对小鼠的下肢缺血也有很好的治疗效果,因此认为间充质干细胞移植是治疗下肢缺血性疾病的有效细胞疗法。
间充质干细胞作为治疗下肢缺血性疾病的新疗法,其治疗机制并不十分明确,可能的机制如下(图2-2-15)。①直接分化:在体内外试验中都证明间充质干细胞可以向血管内皮细胞和血管平滑肌细胞分化。间充质干细胞在缺血损伤部位直接分化成内皮细胞和平滑肌细胞,进而演变成毛细血管,再逐步塑性为侧支循环以改善缺血损伤部位的血供。②分泌可溶性细胞因子:间充质干细胞在炎症环境的诱导下分泌大量的可溶性细胞因子,从而募集、调节干细胞和其他的成熟细胞来对损伤部位进行调节。间充质干细胞分泌SDF-1以诱导其他干细胞向缺血部位趋化定植,并且分泌VEGF和bFGF等细胞因子以促进造血干细胞和内皮祖细胞向血管内皮细胞和血管平滑肌细胞分化。同时,间充质干细胞分泌一些炎症抑制因子TGF-β、PGE2、IL-10,抑制缺血损伤部位的炎症反应,加速组织修复。目前,越来越多的学者认为间充质干细胞的旁分泌作用比直接分化在下肢缺血性疾病中发挥更大的作用。
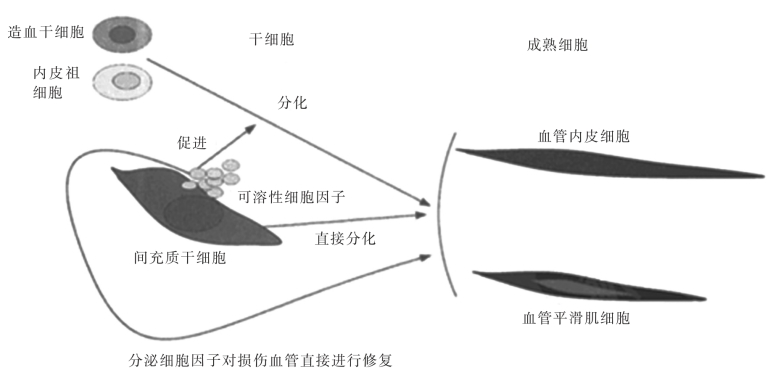
图2-2-15 间充质干细胞移植治疗下肢缺血性疾病的机制[15]。
(3)系统性硬化症
系统性硬化症是一种自身免疫性结缔组织病,主要特点是免疫系统的激活、内皮细胞功能失调导致的血管损坏、皮肤和各种内脏器官胶原沉积,临床表现为皮肤损害和(或)肺、肾等内脏损害,预后较差,目前尚无有效治疗方法,常规免疫抑制治疗效果不显著。
2008年Christopeit等报道了1例严重进行性系统性硬化症(SSc)患者,患者治疗前表现为多处指尖和指关节溃疡、四肢和躯干大面积皮肤纤维化,以及肌腱和关节纤维化,接受异体间充质干细胞(CD137配型相同)治疗后,其手足溃疡等症状得到明显改善,患者主诉肌腱和肌肉僵硬有缓解,血管超声显示手部血液循环有明显改善(图2-2-16),其安全性也得到证实[7]。2009年,南京鼓楼医院与北京汉氏联合生物技术有限公司首席科学家韩忠朝教授合作使用人脐带间充质干细胞移植治疗1例难治性SSc合并下肢溃疡的患者,短期疗效较为显著[8](图2-2-17)。另外Akiyama等发现异体脐带间充质干细胞移植可改善SSc患者病情,包括皮肤溃疡的改善、抗核抗体水平的降低、改良的Rodnan皮肤评分(Modified Rodnan Skin Score,MRSS)和健康评估问卷疾病活动度(Health Assessment Questionnaire disease activity index,HAQ-DI)评分改善。进一步的实验发现,MSC促进外周CD4+T细胞的凋亡,增加Treg的数量,并增加TGF-β的表达水平。而SSc患者自身MSC表达Fas/FasL水平降低,其诱导T细胞凋亡和分泌MCP-1的能力亦减弱[9]。
(4)移植物抗宿主病
现在异基因造血干细胞移植(allo-HSCT)广泛应用于包括白血病等在内的恶性血液病及某些实体瘤的治疗,但急性移植物抗宿主病(aGVHD)仍是allo-HSCT后的主要并发症和死亡原因。
广州南方医科大学南方医院对22例二线药物治疗无效的难治性aGVHD患者在原有免疫抑制剂基础上,采用HLA不合的第三方供体骨髓来源间充质干细胞治疗,在接受MSC治疗后,12例患者获得完全缓解,4例获得部分缓解,总有效率为72.7%[11]。Le Blanc等应用HLA相合同胞、单倍体及HLA不相合的第三方骨髓间充质干细胞治疗13例激素耐药难治性Ⅲ~Ⅳ度aGVHD患者及2例广泛型cGVHD患者,结果在aGVHD患者中6例治愈、4例改善、1例稳定、2例无效[12]。Ringden等应用HLA相合或不相合血缘相关供者间充质干细胞治疗8例激素耐药难治性Ⅲ~Ⅳ度aGVHD及1例cGVHD患者,其中6例治愈,以胃肠道aGVHD效果显著,显著优于同期未应用间充质干细胞(MSC)患者[13]。相关的研究表明,无论间充质干细胞来源于第二方或第三方,其对于难治性aGVHD均有一定疗效。(https://www.xing528.com)
304医院、武警总医院和北京汉氏联合生物技术有限公司首席科学家韩忠朝教授合作,对50例难治性/复发性白血病患者进行共移植,移植细胞有半相合造血干细胞和间充质干细胞(MSC),移植前进行清髓处理[14]。研究结果显示,所有接受MSC的患者表现出稳定的造血植入,并没有出现输注MSC的相关副作用。中性粒细胞和血小板的平均恢复时间分别为12天和15天,并没有观察到严重的急性GVHD和泛发的慢性GVHD发病增多。Ⅱ~Ⅳ级急性GVHD发病率为24.0%,慢性GVHD发病率为37.7%。只有5位患者在192天时复发。患者的2年后无进展存活率为66.0%(图2-2-18)。研究结果表明,这种新的策略在促进供者造血干细胞植入和减少严重GVHD方面是有效的,并为治疗高危恶性血液病提供可行性选择。
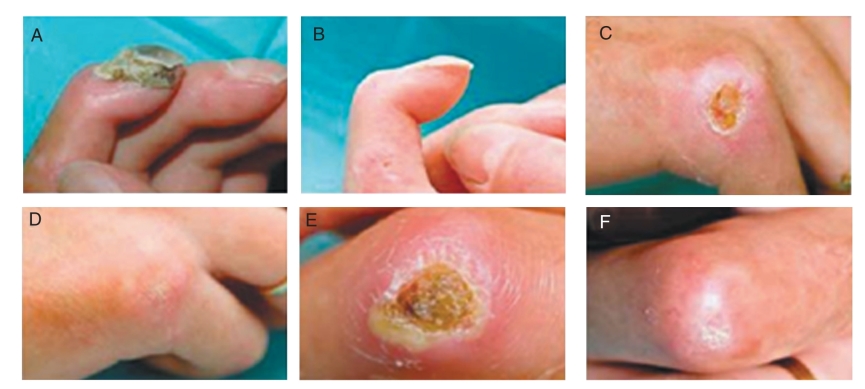
图2-2-16 使用间充质干细胞治疗系统性硬化症前后比较[7](一)。
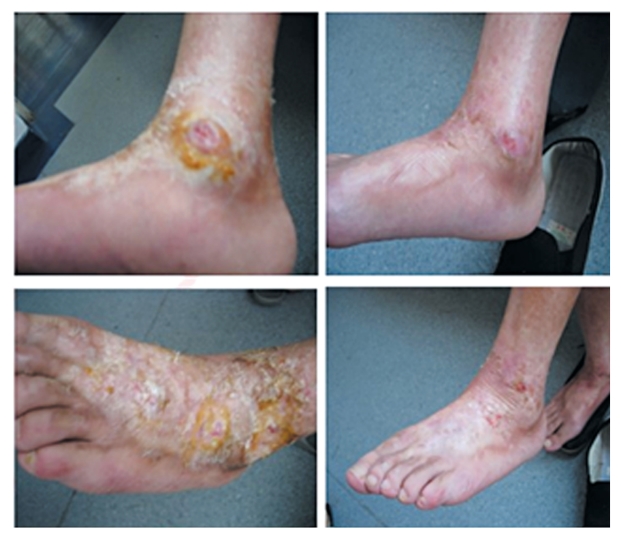
图2-2-17 使用间充质干细胞治疗系统性硬化症前后比较[10](二)。
尽管MSC治疗aGVHD的临床作用已被广泛认可,但其在体内发挥免疫作用的确切机制仍很不清楚。从相关的研究结果推测,静脉输注的MSC可能通过向骨髓和GVHD靶器官等损失组织归巢,实现与淋巴细胞的接触,在局部发挥免疫抑制和组织修复作用,从而起到预防和治疗GVHD的作用[15]。
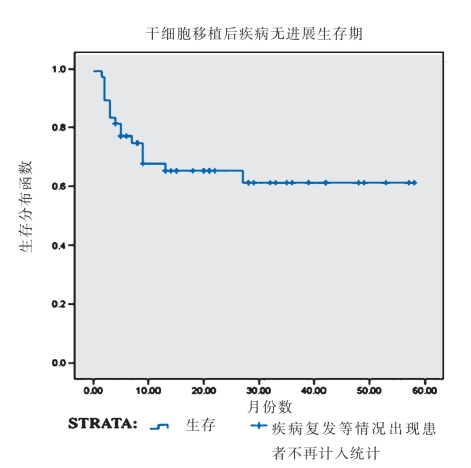
图2-2-18 移植治疗后的无恶化生存期[14]。
(5)缺血性心脏病
间充质干细胞(MSC)治疗缺血性心脏病最令人振奋的结果来自于2007年5月Osiris完成的异体间充质干细胞药物治疗缺血性心脏病的一项随机、对照、双盲试验[16]。该项试验入组了56名缺血性心脏病患者。给予MSC治疗,各剂量组患者耐受性良好。随访6个月,治疗组较对照组发生心率失常的可能性减少了75%,发生室性期前收缩的可能性减少了50%。治疗组由于前壁心肌梗死而引发心功能不全的患者,其射血分数3个月提高了24%,6个月提高了25%,而安慰剂对照组的心功能未见明显提高;治疗组肺功能显著改善,标志肺功能改善的FEV1%(一秒钟用力呼气量与用力肺活量比值)提高了3倍;治疗组有42%的患者全身状态得到改善,而对照组仅有11%患者得到相应的改善。在此研究的基础上,目前关于MSC药物治疗心脏病的更大规模的临床试验正在深入开展。
MSC移植用于治疗缺血性心脏病的作用机制尚不清楚,目前观点主要集中于两个方面[17]:一方面是MSC分化为心肌样细胞,参与心脏的修复,提高心功能;另一方面是移植入体内的MSC通过旁分泌机制促进血管再生、提高毛细血管密度,挽救濒死心肌、增强心肌收缩力,缩小瘢痕,从而提高心功能。另外,相关研究表明,在心肌梗死区域,MSC从血管周围迁移至心肌处,然后释放旁分泌因子,调节血管再生,稳定衰退的微血管,给予营养支持,并调节微环境的自身平衡,使心功能得到改善。CXCR4与其配体SDF-1结合,增强了MSC迁移和存活,显示出梗死区肌肉血管再生增强和胶原纤维Ⅰ/Ⅲ比例减少,减少心肌重塑[17]。
(6)艾滋病免疫重建失败
解放军第302医院全军传染病研究所王福生所长领衔的课题组在结合国际上有关间充质干细胞研究进展的基础上,开展了大量临床前研究并发现,间充质干细胞对难治性免疫重建失败的艾滋病患者可能具有治疗作用。他们对13位经过长期抗病毒治疗、但免疫重建失败的艾滋病患者,进行了为期12个月的间充质干细胞治疗和随访,发现患者体内的CD4 T淋巴细胞数量显著升高,免疫功能得到有效重建,患者得到有效治疗(图2-2-19)[18]。
(7)干燥综合征
干燥综合征是一种以淋巴细胞浸润泪腺、唾液腺等为主的慢性自身免疫性疾病,又称为自身免疫性外分泌腺体病,主要表现为干燥性角膜结膜炎、口腔干燥症或伴发类风湿性关节炎等其他风湿性疾病,它可累及其他系统如呼吸系统、消化系统、泌尿系统、血液系统、神经系统以及肌肉、关节等造成多系统、多器官受损。
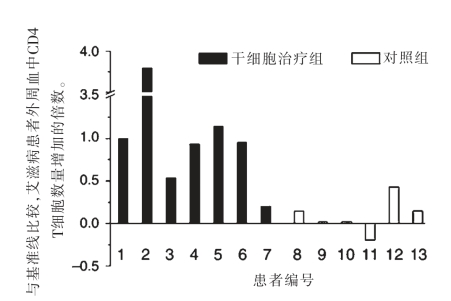
图2-2-19 经MSC治疗后,免疫重建失败艾滋病患者外周血中CD4 T细胞数量增加的倍数[18]。
近来,首都医科大学口腔医学院、南京大学医学院附属鼓楼医院以及中南大学湘雅医院的研究人员使用脐带来源的MSC治疗干燥综合征(SS)患者取得了较为显著的疗效[19]。据该研究报道,24例接受间充质干细胞移植(MSCT)的SS患者(其中11例仅表现为口眼干燥,13例合并严重并发症,包括血小板减少、难治性溶血性贫血、间质性肺病、肾小管性酸中毒、干燥相关的自身免疫性肝病、难治性肠病和神经系统损害),治疗前SSDAI评分的基础值为5.63±1.44,接受MSCT后2周、1个月、3个月、6个月、12个月的SSDAI评分分别为4.58±1.67、4.33±1.79、4.08±1.44、3.46±1.18、3.08±1.21(图2-2-20)。45.8%的患者在3个月时SSDAI评分下降幅度大于30%,70.8%的患者在6个月时SSDAI评分下降幅度大于30%,83.3%的患者在12个月时SSDAI评分下降幅度大于30%。全面评价患者的VAS评分,在治疗后2周时的改善最为显著,在1个月、3个月、6个月、12个月时也表现为进一步改善。11例口眼干燥的患者在治疗后2周时,其唾液流率显著改善,1个月时升高2倍;除3例合并神经系统损害患者治疗后效果不佳外,其余合并严重并发症患者治疗后均有不同程度的改善。此外,接受MSCT治疗1个月后,患者血清中抗SSA与抗SSB抗体的滴度均显著下降,其中抗SSB滴度下降幅度达50%,无不良反应发生。
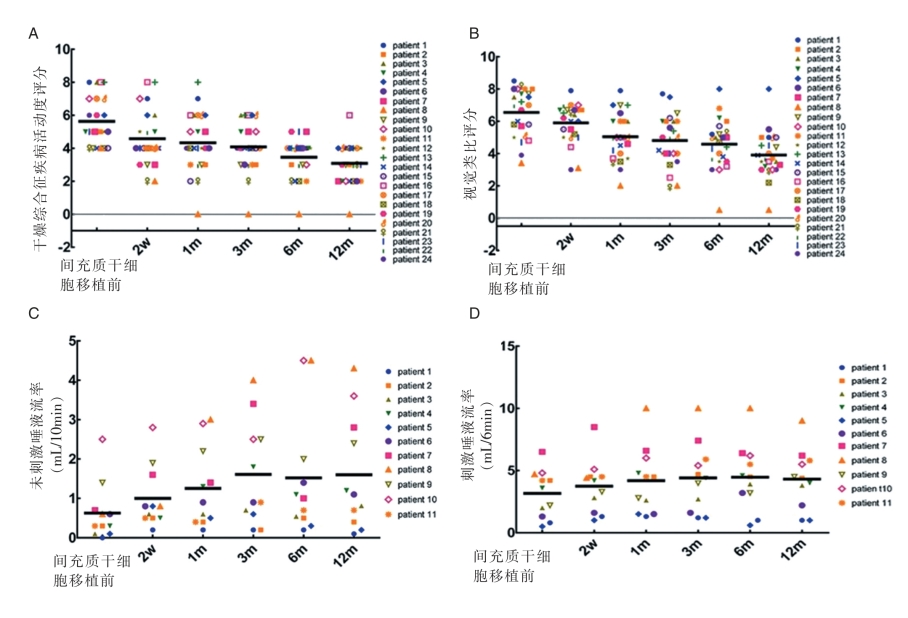
图2-2-20 异基因间充质干细胞治疗改善干燥综合征患者的唾液腺功能和抑制疾病活动[19]。
(8)膝关节半月板部分切除损伤修复
膝关节半月板损伤是最常见的关节内损伤,目前主要的治疗方法是半月板部分切除,但其可导致关节软骨退行性变、关节腔变窄和早期骨性关节炎。间充质干细胞具有向骨、软骨、脂肪等间质组织来源细胞分化的能力,并拥有良好的免疫调节作用。因此在再生医学中,将间充质干细胞用于修复骨及软骨损伤具有很高的研究和应用价值(图2-2-21)。
Centeno等[20]在一位骨关节炎患者的关节内注射透明质酸后注射间充质干细胞。注射间充质干细胞后一周及两周时再注射血小板溶解产物及地塞米松。实验前后MRI结果比较显示,半月板的体积增大,患者自述疼痛减轻,膝关节活动范围增大。
由Osiris公司[21]发起的Ⅰ/Ⅱ期临床试验在美国几个主要的运动医学中心开展。对55位患者进行前瞻性随机对照双盲研究,评价关节半月板切除术后在关节囊注射间充质干细胞的安全性及对组织再生和骨关节炎发生的影响,试验分为治疗组、安慰剂组和对照组(透明质酸组),在外科手术治疗后一周进行,然后由矫形外科医生采用MRI检测恢复情况。对55位患者随访一年的研究表明,接受干细胞治疗关节炎在临床上和统计学上都有显著意义。注射干细胞的骨关节炎患者比对照组疼痛减轻,30%注射间充质干细胞治疗患者的软骨基线和关节状况得到改善,而安慰剂组无此种改善。同时注射间充质干细胞的患者有很好的耐受性,并无严重的副作用,无任何血液疾病发生,无异常的组织生成。

图2-2-21 利用干细胞再造软骨组织[22]。
参考文献
[1]Yang ZX,Han ZB,Ji YR,et al.CD106 identifies a subpopulation of mesenchymal stem cells with unique immunomodulatory properties[J].PLoS One.,2013,8(3):e59354.
[2]Jiang R,Han Z,Zhuo G,et al.Transplantation of placentaderived mesenchymal stem cells in type 2 diabetes:a pilot study[J].Front.Med.,2011,5(1):94-100.
[3]Meirelles Lda S,Fontes AM,Covas DT,et al.Mechanisms involved in the therapeutic properties of mesenchymal stem cells.Cytokine Growth Factor Rev,2009,20(5-6):419-427.
[4]Bonfield TL,Caplan AI.Adult mesenchymal stem cells:an innovative therapeutic for lung diseases[J].Discov Med.,2010,9(47):337-345.
[5]李国剑,杨镛,杨国凯,等.自体外周血干细胞移植治疗血栓闭塞性脉管炎的临床应用[J].中国普外基础与临床杂志,2012,19(11):1187-1190.
[6]Kim SW,Han H,Chae GT,et al.Successful stem cell therapy using umbilical cord blood derived multipotent stem cells for Buerger's disease and ischemic limb disease animal model[J].Stem Cells,2006,24(6):1620-1626.
[7]Christopeit M,Schendel M,Foll J,et al.Marked improvement of severe progressive systemic sclerosis after transplantation of mesenchymal stem cells from an allogeneic haploidentical related donor mediated by ligation of CD137L[J].Leukemia,2008,22:1062-1064.
[8]Lingyun Sun,Huayong Zhang,Fei Gu,et al.Treatment of refractory systemic sclerosis with human umbilical cord derived mesenchymal stem cell transplantation[J].Cell Research,2008,18:s71.doi:10.1038/cr.2008.161.
[9]Akiyama K,Chen C,Wang D,et al.Mesenchymal stem cell induced immunoregulation involves FAS-ligand-/FAS-mediated T cell apoptosis.Cell Stem Cell,2012,10:544-555.
[10]顾菲,张华勇,冯学兵,等.脐带间充质干细胞移植治疗难治性系统性硬化症一例[J].中华风湿病学杂志,2009,13(3):208-209.
[11]赵珂,黄芬,彭延文,等.间充质干细胞作为难治性急性移植物抗宿主病挽救性治疗的临床观察[J].中华血液学杂志,2013,34(2):122-126.
[12]Le Blanc K,Frassoni F,Ball L,et al.Mesenchymal stem cells for treatment of severe acute and extensive chronic graft versushost disease[J].Blood(ASH Annual Meeting Abstracts),2005,143(106).
[13]Ringden O,Uzunel M,Rasmusson I,et al.Mesenchymal stem cells for treatment of threapy-resistant graft-versus-host disease[J].Transplantation,2006,81:1390-1397.
[14]Wu Y,Cao Y,Li X,et al.Cotransplantation of haploidentical hematopoietic and umbilical cord mesenchymal stem cells for severe aplastic anemia:Successful engraftment and mild GVHD.Stem Cell Res,2013,12(1):132-138.
[15]韩忠朝.间充质干细胞基础与临床[M].北京:科学出版社,2012.
[16]Joshua Hare.Clin Cardiol.Jul,2007,30(7):364.
[17]侯婧,吕安林,燕学波.间充质干细胞治疗缺血性心脏病的机制[J].中华临床医师杂志(电子版),2011,5(8):2353-2356.
[18]Zhang Z,Fu J,Xu X,et al.Safety and immunological responses to human mesenchymal stem cell therapy in difficult-to-treat HIV-1-infected patients.AIDS,2013,27(8):1283-1293.
[19]Xu Junji,Wang Dandan,Liu Dayong,et al.Allogeneic mesenchymal stem cell treatment alleviates experimental and clinical Sjögren syndrome[J].Blood,2012,120(15):3142-3151.
[20]Centeno CJ,Busse D,Kisiday J,et al.Regeneration of meniscus cartilage in a knee treated with percutaneously implanted autologous mesenchymal stem cells[J].Med Hypotheses,2008,71(6):900-908.
[21]http://investor.oeiris.com/releasedetail.cfm?ReleaseID=229686.
[22]http://www.intechopen.com/books/tissue-engineering-for-tissue-andorgan-regeneration/cartilage-tissue-engineering-the-application-of-nanomaterials-and-stem-cell-technology.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




