1.显色剂用量
生成有色络合物的反应,一般可用下式表示:
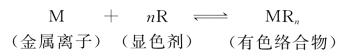
为保证显色反应尽可能地进行完全,一般需加入过量显色剂。对于稳定性较高的有机络合物,只要加入稍过量的显色剂,显色反应就能定量进行。但对某些生成逐级络合物的反应,就要严格控制显色剂的用量。
显色剂用量是通过实验来确定的。一般是这样做的:固定被测组分的浓度和其他条件,分别加入不同量的显色剂,测定吸光度,以吸光度为纵坐标,试剂用量(试剂浓度cR或加入的体积V)为横坐标作图。通常有三种情况,如图9-11所示。
图9-11(a)曲线表明,随着显色剂用量的增加,溶液的吸光度也不断增加,当显色剂用量达到某值时,吸光度不再增加,保持恒定值,出现平坦部分,这表明,显色剂量已足够,故可在平坦区域选择合适的显色剂用量。图9-11(b)与(a)不同的地方是曲线的平坦部分很窄,表示显色剂用量仅在a′~b′内,吸光度才较稳定。显色剂用量小于a′或大于b′,吸光度都下降,因此必须严格控制显色剂用量。例如Mo(Ⅴ)与SCN-生成一系列配位数不同的络合物:
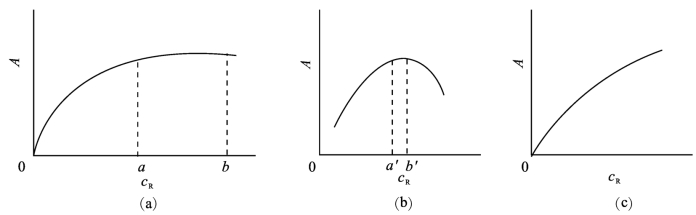
图9-11 吸光度与显色剂用量的关系

用光度法测定时,一般是测Mo(SCN)5的吸光度,如果SCN-浓度太低或太高,吸光度都降低。因此应严格控制显色剂的量,否则得不到正确的结果。图9-11(c)所示与前面两种情况完全不同,当显色剂用量增大时,吸光度随之增大,例如用SCN-测定Fe3+,随着SCN-用量增大,生成颜色愈来愈深的高配位数络合物Fe(SCN)-4、Fe(SCN)2-5等。只有严格控制显色剂用量,才能进行测定。
2.溶液酸度的影响(https://www.xing528.com)
由于大多数显色剂为有机弱酸或弱碱,而金属离子常会发生水解,溶液酸度改变时就必然会引起以下副反应:
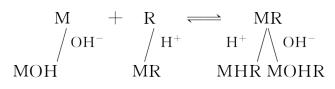
从而影响显色剂、金属离子的存在形态以及络合物的组成、稳定性和显色反应的实际完全程度。溶液的酸度对副反应有较大的影响,因而对溶液的吸光度有较大的影响。
显色反应的适宜酸度范围,通常是通过实验来确定的。其方法是固定溶液中待测组分和显色剂的浓度,改变溶液的pH 值,测定吸光度,作出A-pH 曲线,如图9-12所示。曲线中间一段A 较大而又恒定的平坦部分所对应的pH 值范围就是适宜的酸度范围,可以从中选择一个pH 值作为测定时的酸度条件。
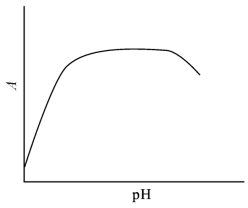
图9-12 吸光度与溶液酸度的关系
3.显色时间及颜色稳定时间
由于显色反应完成的速度不同,溶液颜色达到稳定状态所需时间也不同。有些有色络合物能瞬间形成,颜色很快达到稳定状态,并能保持较长时间,大多数显色反应速度较慢,需要一定时间,溶液颜色才能达到稳定;有些有色络合物虽能迅速形成,但颜色很快减退,使吸光度下降。适宜的显色时间及颜色稳定时间也是通过实验确定的。配制一份显色溶液,从加入显色剂计算时间,每隔一段时间测定一次吸光度,绘制A-t曲线,根据曲线来确定最适宜的显色时间和颜色稳定时间。
4.显色温度
多数显色反应在室温下进行,有少数反应在室温下进行很慢,必须加热至一定温度才能迅速完成;但有些有色化合物在温度偏高时易分解,为此应根据不同情况选择适当的温度进行显色。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




