当沉淀析出时,溶液中一些本不应沉淀的杂质,一起沉淀出来,这种现象叫共沉淀。例如重量法测定Na2SO4溶液中的,加入过量的沉淀剂BaCl2,生成BaSO4沉淀。剩余![]() 的BaCl2本不会沉淀,但实际上在BaSO4沉淀的同时有少量BaCl2随之沉淀出来。这一共沉淀作用使得BaSO4沉淀沾污了BaCl2杂质。
的BaCl2本不会沉淀,但实际上在BaSO4沉淀的同时有少量BaCl2随之沉淀出来。这一共沉淀作用使得BaSO4沉淀沾污了BaCl2杂质。
共沉淀作用根据其产生的原因分为吸附共沉淀、包藏共沉淀和混晶共沉淀三种。
1.吸附共沉淀
顾名思义,吸附共沉淀是由沉淀表面的吸附作用引起的共沉淀。例如用KCl作沉淀剂沉淀Ag NO3溶液中的Ag+时,处在AgCl沉淀表面上的构晶离子的电荷作用力是不均衡的,存在着指向沉淀颗粒内部的力场,这种剩余力会吸引溶液中带有相反电荷的离子,形成一个吸附层。
沉淀表面的吸附作用有如下规律:
(1)优先吸附构晶离子;
(2)如果无过量构晶离子存在时,则优先吸附可与构晶离子形成溶解度小的化合物的离子以及与构晶离子半径相近、电荷相等的离子。
根据这一规律,在该例中,当加入过量的KCl时(重量分析时一般都使沉淀剂过量),AgCl沉淀表面首先吸附的是溶液中剩余的构晶离子Cl-(而不是NO-3或K+),于是在AgCl沉淀的表面上便形成了一个由Cl-组成的带负电荷的吸附层,如图8-2所示。
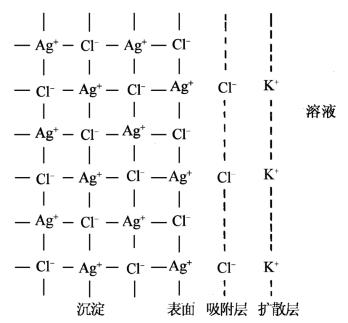
图8-2 AgCl表面吸附示意图
由于吸附层带负电荷,必然会在吸附层的外面再吸附一层带有相反电荷的离子(该例为K+),形成一个带正电荷的离子层,叫做扩散层。扩散层中的离子(K+)叫做抗衡离子。吸附层对抗衡离子的吸附也是有规律的:优先吸附可与吸附层离子形成溶解度小的化合物的离子,其次是电荷高、浓度大的离子。在该例中若还共存有Mg2+,则抗衡离子应是Mg2+而不是K+。
吸附层和扩散层共同组成了包围着沉淀颗粒表面的双电层。处于双电层中的正、负离子的电荷总数是相等的,构成了被沉淀表面吸附的杂质化合物,在该例中KCl(或MgCl2)就是沾污AgCl沉淀的杂质。
抗衡离子被吸附的力较小,当增大溶液中其他带有相同电荷离子的浓度时,原抗衡离子可能被置换下来,这一现象称为竞争吸附。在重量分析中利用这一现象可以以洗涤的方法除去沉淀表面吸附的杂质。如上述AgCl沉淀可以用稀HNO3洗涤,在洗涤过程中原抗衡离子K+(或Mg2+)被洗液中大量的H+置换下来。洗涤后的AgCl表面吸附的HCl可在烘干或灼烧过程中挥发除掉。
沉淀表面对杂质的吸附量与下列因素有关:(https://www.xing528.com)
(1)相同量的沉淀,总表面积大的(颗粒小的)沉淀吸附杂质的量也大。因此重量分析时应尽量创造条件获得大颗粒沉淀,以减少吸附共沉淀造成的沾污。
(2)溶液中杂质浓度大,吸附量也大。
(3)升温可以减少吸附,因为吸附是一放热过程。
![]()
温度升高时平衡向解吸方向移动,吸附量减少。实际分析中,常用加热的方法减少吸附共沉淀的影响。


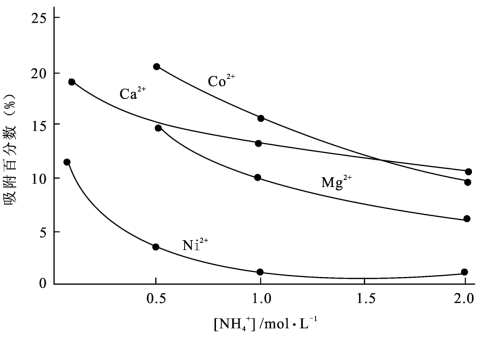
图8-3  对Fe(OH)3吸附的影响(〔NH3〕=0.90 mol/L)
对Fe(OH)3吸附的影响(〔NH3〕=0.90 mol/L)
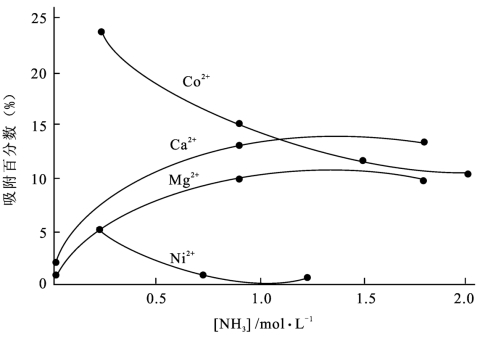
图8-4 〔NH3〕对Fe(OH)3吸附的影响 〕=1.00 mol/L)
〕=1.00 mol/L)
2.包藏(吸留)共沉淀

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




