1.沉淀物质的本性
原则上讲在沉淀形成的过程中,如果晶核的生成速度很快,在极短的时间内就可形成大量的晶核,溶液中其余的构晶离子要分散在众多的晶核上沉积长大,故只能得到较小颗粒的沉淀。另外当沉淀微粒的聚集速度大于定向速度的时候,也易形成小颗粒的无定形沉淀;反之则形成大颗粒的晶型沉淀。而成核速度、聚集和定向速度的大小与沉淀物质的本性有关。一般来讲,强极性的无机盐,如BaSO4、CaC2O4、Mg NH4PO4都有较大的定向速度,易形成较大颗粒的晶型沉淀。一些高价金属离子的氢氧化物及硫化物如Al2O3·n H2O、Fe2O3·n H2O、Ag2S,定向速度小,聚集速度大,水合的构晶离子来不及脱水就聚集成疏松带水的无定形沉淀了。
2.过饱和程度
溶液的过饱和程度直接影响着晶核的生成速度,影响沉淀颗粒的大小。冯·韦曼(Von Weimarn)通过对BaSO4沉淀的研究提出了经验公式:
![]()
式中分散程度可代表颗粒的大小;K 是常数,与沉淀的本性、介质及温度有关;Q 表示加入沉淀剂后瞬间的浓度,称为初始浓度或瞬间浓度;S 为开始沉淀时初生的小颗粒沉淀的溶解度,称为初始溶解度;Q-S为加入沉淀剂后瞬间的过饱和程度:![]() 则为相对过饱和程度。
则为相对过饱和程度。
韦曼公式表明,溶液相对过饱和程度愈大,沉淀的颗粒愈小。表8-1是在不同相对过饱和程度下沉淀BaSO4时,所得沉淀的类型。
表8-1 相对过饱和程度对BaSO4颗粒的影响

当沉淀的初始浓度Q 相同时,沉淀的初始溶解度愈小,愈易得到颗粒小的沉淀。BaSO4的初始溶解度比其正常溶解度要大得多,而AgCl的初始溶解度则与其正常溶解度相差不多。在相同的初始浓度下,BaSO4的过饱和程度远小于AgCl的过饱和程度,故在通常条件下沉淀BaSO4一般可得到晶型沉淀,而沉淀AgCl则往往得到凝乳状沉淀。
许多研究结果表明,沉淀的颗粒并不是随着相对过饱和程度的下降而持续增大,而是在某一较小的过饱和程度时,颗粒最大,若过饱和程度再下降则颗粒反而变小。可见韦曼公式只能在一定的范围内定性地说明沉淀颗粒大小对过饱和程度的依赖关系。(https://www.xing528.com)
3.临界比Q0/S
在研究BaSO4沉淀的晶核数目与初始浓度的关系时得图8-1。曲线的横坐标为初始浓度的对数(lg Q),纵坐标为每立方米溶液中晶核数目的对数(lg N/cm3)。
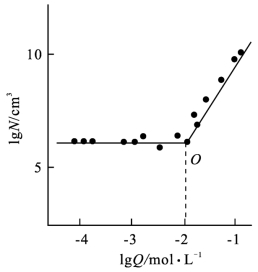
图8-1 BaSO4晶核数目与初始浓度关系
曲线在O 处有一转折点,称为临界点。临界点的横坐标用lg Q0表示,该例lg Q0=-2。当lg Q<lg Q0时,晶核数目基本不变且与初始浓度(Q 值)无关,表明在此区间只有异相成核作用。当lg Q>lg Q0时,晶核数目增多,且随初始浓度的增大而增多,说明在此范围内既有异相成核作用又有均相成核作用。通常将临界点对应的相对过饱和程度,即![]() 称为临界值。在一般情况下Q0≫S,故临界值可简化成Q0/S,Q0/S 称为临界比。
称为临界值。在一般情况下Q0≫S,故临界值可简化成Q0/S,Q0/S 称为临界比。
不同的难溶化合物其临界比是不相同的。表8-2列出了一些物质的临界比值。临界比Q0/S 较大的物质(图中临界点偏右)均相成核作用少,易得到颗粒大的晶型沉淀。临界比Q0/S 小的物质,均相成核作用较大,易得到颗粒小的沉淀。
表8-2 难溶化合物的临界比(Q0/S)
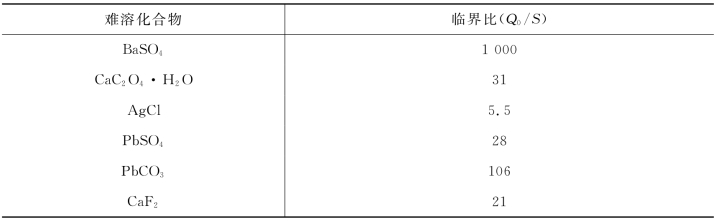
在沉淀时为了得到较大颗粒的沉淀,应控制初始浓度与溶解度之比(Q/S),尽量不超过或少超过临界比Q0/S。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




