氧化还原滴定所用的指示剂有如下几类。
1.自身指示剂
利用滴定剂或被滴物质本身的颜色变化来指示滴定终点,无需另加指示剂,称为自身指示剂(法)。例如在酸性介质中用KMnO4滴定Fe2+或C2O2-4等浅色或无色还原剂时,还原产物Mn2+颜色又很浅,在化学计量点后只要有很少量的过量的KMnO4(~2×10-6 mol/L)就能使溶液呈淡紫红色,指示终点的到达,过量的KMn O4所产生的误差可以控制得很小。
2.特殊指示剂(或称显色指示剂)
一些物质若能与滴定剂或被滴物质发生灵敏的可逆显色反应,就可作为指示剂,称为特殊指示剂。如用Fe3+标准溶液滴定Ti3+,可选用特殊指示剂SCN-,终点时稍过量的Fe3+可与SCN-生成红色络合物,指示终点到达。另一个十分重要的示例是淀粉,它可与I-3形成深蓝色络合物,用以确定碘量法的终点,灵敏度极高,I-3的浓度为10-5 mol/L时即可显蓝色,该显色反应的可逆性好,终点变色敏锐。但是淀粉指示剂敏锐程度与淀粉的质量有关。为防止淀粉变质,在配制时可加入少许碘化汞作防腐剂。
3.氧化还原指示剂
在氧化还原滴定中使用最多的是氧化还原指示剂。这类指示剂具有氧化还原性质,其氧化态和还原态的颜色不同。在滴定过程中,指示剂也随之发生氧化还原反应,由于氧化态和还原态浓度比的变化引起溶液颜色的变化,从而指示终点。
氧化还原指示剂的半反应可用下式表示:
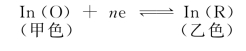 (https://www.xing528.com)
(https://www.xing528.com)
若半反应是可逆的,则
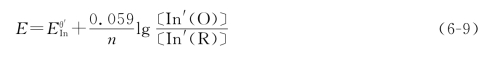
与酸碱指示剂相似:

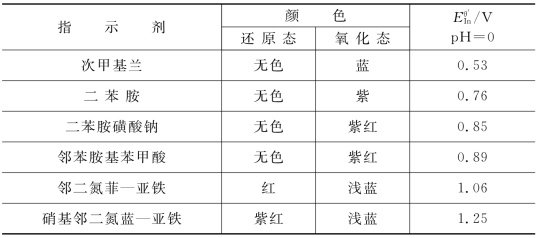
选择指示剂时,应使指示剂在突跃范围之内变色,指示剂变色点的电位尽可能与化学计量点相一致。如在0.5 mol/L H2SO4中,用Ce4+滴定Fe2+,已知Esp=1.06 V,ΔE突0.86~1.26 V,查表6-4,选择邻二氮菲-亚铁为最适宜,也可选用邻苯氨基苯甲酸。若选二苯胺磺酸钠则会使终点提前。又如在1 mol/L H2SO4介质中,用K2Cr2O7滴定Fe2+,已知ΔE突0.86~1.02 V,选用邻苯胺基苯甲酸为宜,选用邻二氮菲-亚铁则变色太迟,选用二苯胺磺酸钠终点提前;但是若在1 mol/L 的H2SO4-H3PO4混合酸介质中,由于H3PO4与Fe3+ 的较强的络合作用可使![]() 降至0.44 V,ΔE突为0.62~0.99 V,所以此时二苯胺磺酸钠成为适宜的指示剂,邻苯胺基苯甲酸仍能适用。
降至0.44 V,ΔE突为0.62~0.99 V,所以此时二苯胺磺酸钠成为适宜的指示剂,邻苯胺基苯甲酸仍能适用。
表6-4 一些常用氧化还原指示剂
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




