1.误差公式和误差图


表5-5 Δp M'与f=10ΔpM'-10-ΔpM'换算表
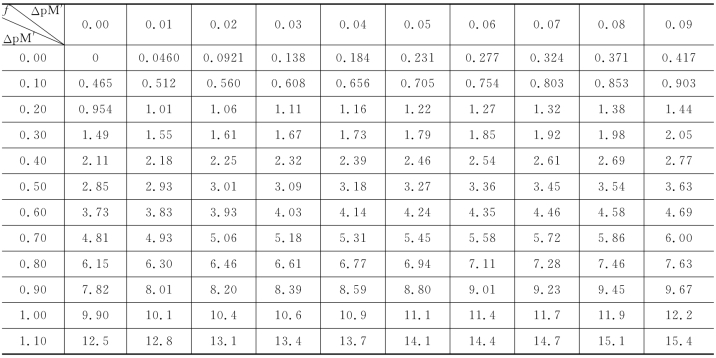
续表
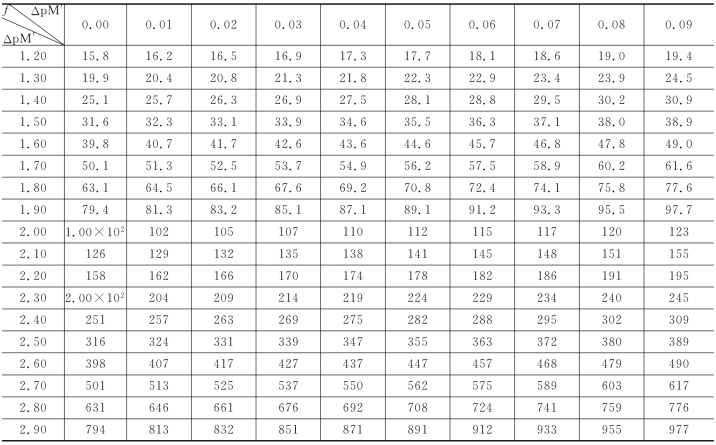
换算示例:①已知Δp M′=0.32,查Δp M′=0.30与0.02,得f=1.61;②已知f=-1.11,查Δp M=-(0.20+0.03)=-0.23。
将式(5-16-c)取对数,得

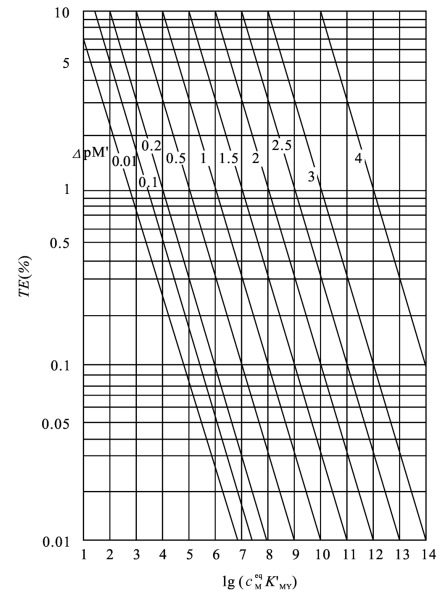
图5-10 滴定误差图
f=1.26,查表5-4得Δp Mg′=0.26
sp±0.1%处的p Mg′分别为5.1-0.26=4.84 和5.1+0.26=5.36。滴定突跃Δp Mg′(突)=0.26×2=0.52。
用相同方法可计算当TE=±0.2%时Δp Mg′=0.46,即终点与计量点的p M′之差为0.46单位。所谓“目视法”即指用指示剂确定终点的方法。由于人的生理局限性所致,在确定滴定终点时一般有±0.2~0.5p M 单位的不确定性,换言之,只有当p M 改变±(0.2~0.5)个p M 单位时人们才能确认出指示剂颜色的变化。可见该例中所述的滴定,用目视法确定终点可以满足误差在±0.2%范围之内的要求。
【例5-6】在pH=5.0的缓冲液中,用2×10-2 mol/L EDTA 滴定2×10-2 mol/L Cd2+,用二甲酚橙作指示剂,求
(1)变色点时终点误差;(https://www.xing528.com)
(2)若确定终点时还有±0.5p M 单位出入时的终点误差。
解 已知lg KCdY=16.5,pH=5.0时lgαY(H)=6.6,p Cdt(Cd-XO)=4.5。
lg KCdY′=lg KCdY-lgαY(H)=16.5-6.6=9.9


查误差图得TE=-0.1%。
可见滴定Pb2+时,应选用六次甲基四胺作缓冲溶液。
2.准确滴定的判断
能满足指定误差要求的滴定可称为“准确滴定”。如终点误差要求TE=±0.1%时,凡终点误差在-0.1%~0.1%范围内的滴定都属准确滴定。

表5-6 单一离子准确滴定的判据


通常也将|TE|≤0.1%,Δp M′=±0.2,cM=2×10-2 mol/L 称为一般条件。由表5-7可见,在一般条件下只有当![]() 才能被准确滴定。
才能被准确滴定。
表5-7 某些条件下(lg KMY' )ct值

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




