1.滴定过程中p M′和p M 的计算
络合滴定时,被滴试液的特征变化是p M(-lg[M])的变化:随着滴定剂的滴入,被滴溶液中金属离子浓度渐渐减少,p M 渐渐增大,当滴定剂的滴入量和化学计量点相差在±0.1%范围内时,p M 发生突变。以滴定分数或滴定剂体积为横坐标,p M 或p M′为纵坐标作图便得滴定曲线(参看图5-6至图5-9)。
滴定过程中的p M′和p M 值可以用简便方法进行计算。例如,用1.0×10-2 mol/L EDTA滴定相同浓度的M 20.00 mL。假设lg KMY=17.0,lgαY=5.0,lgαM=4.0,忽略MY的副反应并认为在整个滴定过程中αM和αY不变。

由于MY 比较稳定

当然在十分接近化学计量点时,〔M′〕的计算应该考虑MY 的离解,作精确计算。但在一般要求的计算中均可按上述简便方法计算。
按上述方法计算出不同滴定分数时相应的p M′或p M,以T 为横坐标,p M′或p M 为纵坐标便可绘出滴定曲线。
在有关p M′或p M 的计算中以化学计量点时的p Msp′或p Msp计算为最重要。
2.影响滴定突跃范围大小的因素
(1)浓度的影响
从上述p M′的计算可以看出:对于以p M′-T 表示的滴定曲线,当![]() 一定时,金属离子的原始浓度cM愈大,p M′愈小,曲线的前半部分愈低,突跃范围增大,化学计量点位置下移。图5-6为假设金属离子
一定时,金属离子的原始浓度cM愈大,p M′愈小,曲线的前半部分愈低,突跃范围增大,化学计量点位置下移。图5-6为假设金属离子![]() =10,cY=cM=10-1~10-4 mol/L时的一组p M′-T 曲线。(https://www.xing528.com)
=10,cY=cM=10-1~10-4 mol/L时的一组p M′-T 曲线。(https://www.xing528.com)
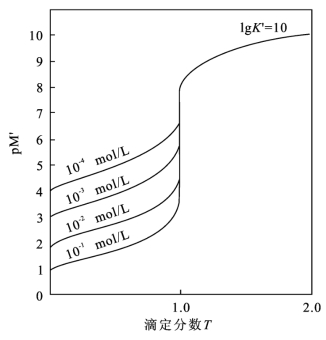
图5-6 不同浓度的滴定曲线(p M'-T)(lg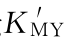 =10,cY=cM)
=10,cY=cM)

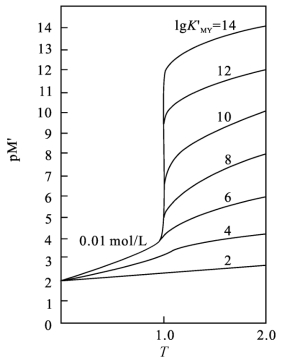
图5-7 不同lg K'MY的滴定曲线(p M'-T)(cY=cM=10-2 mol/L;lg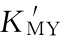 =2~14)
=2~14)


图5-8 pH6~12的EDTA滴定Ca2+的滴定曲线(cY=cCa2+=1.0×10-2 mol/L)
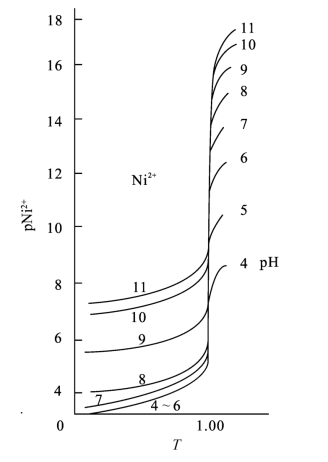
图5-9 pH4~11氨性缓冲液中EDTA 滴定Ni2+的滴定曲线(cY=cNi2+=1.0×10-3 mol/L)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




