1.非水溶剂的分类
(1)质子性溶剂
具有较强的给出质子或接受质子能力的溶剂,可分为三种:
①酸性溶剂
具有较强的给出质子能力的溶剂,例如,甲酸、醋酸、丙酸等。其作用是酸性介质,能增强被测碱的强度。此类溶剂的特点是:酸性大于水,碱性小于水,适用于滴定弱碱性物质。
②碱性溶剂
具有较强的接受质子能力的溶剂,例如,乙二胺、乙醇胺、丁胺等。其作用是碱性介质,能增强被测酸的强度,适用于滴定弱碱性物质。
③两性溶剂
既能给出质子、又能接受质子的溶剂,溶剂分子之间有质子的转移,即质子自递作用,例如,甲醇、乙醇等。此类溶剂的特点是:酸性、碱性与水相似,适用滴定不太弱的酸性或碱性物质。
(2)非质子性溶剂
溶剂分子中无转移性质子的溶剂,分为:
①偶极亲质子性溶剂
溶剂分子中无转移性质子,但具有较弱的接受质子的倾向,且具有程度不同的形成氢键的能力,例如,酮类、酰胺类、腈类、吡啶类。此类溶剂适用于滴定弱酸性物质。
②惰性溶剂
溶剂分子中无转移性质子和接受质子的倾向,也无形成氢键的能力。例如,苯、甲苯、氯仿、四氯化碳等。此类溶剂的特点是不参加酸碱反应,常与质子溶剂混用,用来溶解、分散、稀释溶质。
(3)混合溶剂
质子性溶剂与惰性溶剂混合。例如。冰醋酸-醋酐,冰醋酸-苯,苯-甲醇等,此类溶剂的特点是使样品易溶,滴定突跃增大,终点变色敏锐。
2.溶剂的性质
(1)溶剂的质子自递常数(https://www.xing528.com)
在非水滴定中,常用的溶剂有冰醋酸、醋酸酐、甲醇、乙醇、二甲基甲酰胺等。在这些溶剂中,有的极难电离(离解)或完全不电离(离解);有的却和水一样,在溶剂的分子之间有质子的转移,即质子的自递作用使溶剂本身产生离解。如甲醇和冰醋酸在溶剂中有与水相似的离解平衡,生成溶剂化质子:

Ks被称为溶剂的质子自递常数,或成为溶剂的离子积。它是非水溶剂的重要特性,Ks愈小(即p Ks愈大),质子自递反应进行的程度愈差,滴定单一组分的准确度就愈高。由于可用的pH 范围大,还可以连续滴定多种强度不同的酸(碱)的化合物。一些溶剂的p Ks值列于表4-13中。
表4-13 一些溶剂的p Ks值
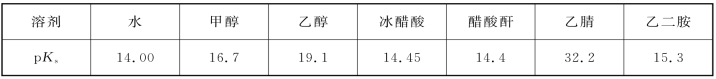
我们可以用水和乙醇的比较来说明p Ks值的意义,在水中,1 mol/L 的强酸溶液的pH值为0;1 mol/L的强碱溶液的p OH 值为0,即pH=14,它们相差14个单位。但在乙醇中,从pH=0变化到p OC2H5=0,它们相差19.1个单位,变化范围较大。对于某些在水中由于突跃范围不明显,而不能进行滴定的酸碱物质,在乙醇介质中,滴定的突跃范围会比较大,滴定终点也比较明显,酸碱滴定也就会成为可能。
(2)溶剂的拉平效应和区分效应
由于酸碱在溶液中的解离是通过溶剂接受或给出质子得以实现的,所以物质的酸碱性强弱不仅仅决定于物质的本性,也与溶剂的酸碱性有关。一些酸或碱在某种溶剂中表现出强酸性或强碱性之间的差异,而在另一种溶剂中却表现不出酸碱性的明显差异。如在水溶液中,HCl O4H2SO4、HCl、HNO3都是强酸,它们将质子转移给H2O,生成H3O+:

四种酸在水溶液中全部解离,碱性较强的H2O 可全部接受其质子,生成H3O+,水将高氯酸、硫酸、盐酸、硝酸的强度拉平到溶剂化质子(H3O+)的水平,使四种酸的强度相同。这种将不同强度的酸(或碱)拉平到溶剂化质子水平,使之强度变为相同的效应被称为拉平效应,具有拉平作用的溶剂被称为拉平溶剂,在此,水是HCl O4、H2SO4、HCl、HNO3的拉平溶剂。
如果在冰醋酸的介质中,它们将质子转移给HAc,生成H2Ac+:
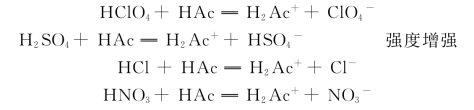
在HAc溶液中,由于HAc碱性<H2O,在这种情况下,这四种酸就不能全部将质子转移给HAc,并且在程度上有差别,即给出质子的程度:
HCl O4>H2SO4>HCl>HNO
这四种酸的强度能显示其差别来,HCl O4的强度最大,这种能够区分酸(或碱)的强弱作用被称为区分效应,具有区分效应的溶剂被称为区分性溶剂,在这里,冰醋酸是这四种酸的区分溶剂。
在非水滴定中,利用拉平效应可以测定混合酸(或碱)的总量,利用区分效应可以分别测定混合酸(或碱)中各组分的含量。
一般而言,惰性溶剂没有明显的酸性和碱性,因此,惰性溶剂没有拉平效应。这样就使得惰性溶剂成为一种很好的区分溶剂。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




