【摘要】:图4-9 0.100 0 mol/L HCl滴定0.100 0 mol/L NH3的滴定曲线2.影响滴定突跃范围大小的因素和弱酸的滴定一样,弱碱的强度和浓度都会影响滴定突跃范围。
强酸滴定一元弱碱与强碱滴定一元弱酸的情况类似。以0.100 0 mol/L HCl滴定20.00 mL 0.100 0 mol/L NH3为例,其滴定反应为:
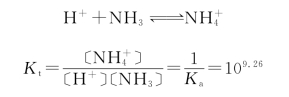
现将滴定过程中pH 的计算结果列于表4-12,并将计算结果绘成滴定曲线,如图4-9所示。
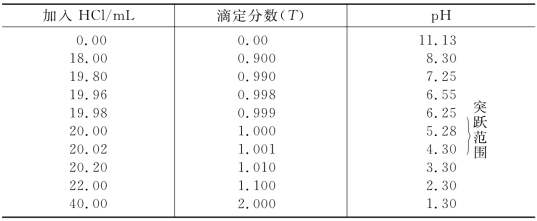
表4-12 0.100 0 mol/L HCl滴定20.00 mL 0.100 0 mol/L NH3的pH 变化
1.指示剂的选择
由表4-12和图4-9可以看出,用0.100 0 mol/L的HCl滴定0.100 0 mol/L的NH3,在计量点时pH 值为5.28,溶液呈弱酸性,滴定突跃范围为6.25~4.30,突跃发生在弱酸性范围,因此必须选择在酸性范围内变色的指示剂,甲基红、溴甲酚绿和溴酚篮等是合适的指示剂。(https://www.xing528.com)
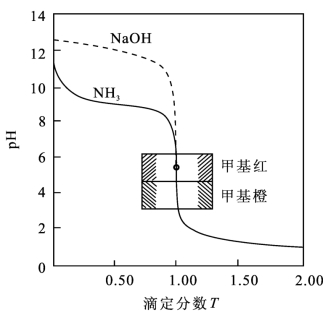
图4-9 0.100 0 mol/L HCl滴定0.100 0 mol/L NH3的滴定曲线
2.影响滴定突跃范围大小的因素
和弱酸的滴定一样,弱碱的强度(Kb)和浓度(c)都会影响滴定突跃范围。当Kb一定,c增大时,突跃起点的pH 值基本不变,但突跃止点的pH 随着c的增大而减小,c增大到10倍,止点pH 减小1个单位,ΔpH突跃增大。当c不变,Kb增大时,突跃止点的pH 值基本不变,但突跃起点的pH 值随着Kb的增大而增大,Kb增大到10倍,起点pH 增大1个单位,ΔpH突跃增大。
3.能直接准确滴定的判据
当终点观察的不确定性为±0.2pH 单位、终点观测误差在±0.1%范围内时,能否以强酸直接准确滴定一元弱碱的判据为c Kb≥10-8。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




