这类滴定的基本反应为:

计量点之前都可按上述通式计算,当然在接近计量点时,由于HCl浓度很稀会产生较大误差。
(3)计量点时:滴入NaOH 溶液20.00 mL,NaOH 和HCl全部反应,溶液呈中性。

计量点之后都可按此方式计算。
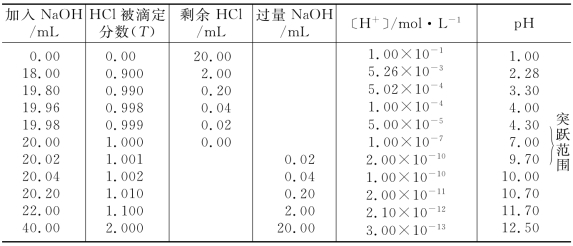
用类似的方法可以计算滴定过程中溶液的pH 值,结果列于表4-8中。
表4-8 0.100 0 mol/L NaOH 滴定20.00 mL0.100 0 mol/L HCl的pH 变化
以NaOH 加入量(或滴定分数)为横坐标,以其对应的pH 值为纵坐标作图,得到如图4-6所示的滴定曲线(实线所示)。

图4-6 0.100 0 mol/L NaOH 滴定0.100 0 mol/L HCl的滴定曲线
从表4-8和图4-6可以看出,在滴定开始时曲线比较平坦,随着滴定的进行,曲线逐渐向上倾斜,在计量点前后(±0.1%)发生较大的变化,以后曲线又比较平坦。这是因为滴定开始时,溶液中剩余的HCl比较多,缓冲容量较大,加入的NaOH 对溶液的pH 值改变不大,所以曲线比较平坦。加入的NaOH 从0.00 mL到19.80 mL,溶液的pH 值从1.0变化到3.3,只增加了2.3个pH 单位。随着滴定的进行,溶液中HCl量减少,缓冲容量下降。当加入的NaOH 溶液为19.98 mL(即滴定分数为0.999)时距计量点仅差0.02 mL 时,pH值的变化幅度较前稍有增大,溶液的pH 为4.30。这时再加入1滴(约0.04 mL)NaOH,不仅将剩下的半滴HCl中和,而且NaOH 还过量了半滴,这一滴之差使溶液的酸度发生了巨大的变化,pH 由4.30急剧增加到9.70,增大了5.4个pH 单位,溶液由酸性变为碱性。我们把计量点前后1滴滴定剂所引起的溶液pH 值的急剧变化,称为滴定突跃;或者说,在计量点前后±0.1%相对误差范围内溶液pH 值的突变,称为滴定突跃。突跃所包括的pH 范围称为滴定突跃范围。(https://www.xing528.com)
化学计量点后,再继续加入NaOH,则进入强碱的缓冲区。溶液的pH 变化逐渐减小,曲线又比较平坦了。加入NaOH 为22.00~40.00 mL的区间,其pH 值的改变也只有0.8个pH 单位。
如果用0.100 0 mol/L HCl滴定0.100 0 mol/L NaOH 则情况相似,但pH 变化方向相反,如图4-6中虚线所示。滴定的突跃范围是pH=9.70~4.30。
2.指示剂的选择
指示剂的选择主要以滴定突跃范围为依据,凡是变色范围全部或一部分在滴定突跃范围内的指示剂都可以用来指示滴定终定。显然,最理想的指示剂应该恰好在计量点时变色。用0.100 0 mol/L NaOH 溶液滴定0.100 0 mol/L HCl时,其滴定突跃的pH 范围为4.30~9.70,所以酚酞、甲基红、甲基橙均适用。若以甲基橙为指示剂,溶液颜色由橙色变为黄色时,溶液pH 为4.4。从表4-8知,未中和的HCl小于0.1%,因此滴定误差不会超过0.1%。
如果用0.100 0 mol/L HCl滴定0.100 0 mol/L NaOH,可选择酚酞和甲基红作指示剂。若用甲基橙作指示剂,是从黄色滴到橙色(pH=4.0,在滴定突跃范围9.70~4.30之外),因此将有+0.2%的误差。为消除这一误差,可进行指示剂校正。校正方法是取40 mL 0.050 mol/L NaCl溶液,加入与滴定时相同量的甲基橙(终点时溶液的情况),再以0.100 0 mol/L HCl溶液滴定至溶液的颜色恰好与被滴定的溶液颜色相同为止,记下HCl的用量(称为校正值)。用滴定NaOH 所消耗的HCl量减去此校正值即为HCl的准确用量。
3.影响滴定突跃范围大小的因素
滴定突跃范围的大小与酸碱的浓度有关(见图4-7和表4-9)。从图4-7和表4-9可以看出,若用0.010 00 mol/L、0.100 0 mol/L、1.000 mol/L 三种浓度的NaOH 标准溶液,分别滴定0.010 00 mol/L、0.100 0 mol/L、1.000 mol/L的HCl溶液,得到的滴定曲线的突跃范围分别为5.30~8.70、4.30~9.70、3.30~10.70。可见溶液愈浓,突跃范围愈大;溶液愈稀,突跃范围愈小。当酸碱浓度增大到10倍时,滴定突跃范围增加两个pH 单位;相反,若浓度降低到1/10时,滴定突跃范围减少两个pH 单位。因此,指示剂的选择受到浓度的限制。对于0.010 00 mol/L NaOH 滴定0.010 00 mol/L HCl,由于突跃范围较小,甲基橙作指示剂就不合适了,可用酚酞,最好用甲基红作指示剂。

图4-7 不同浓度NaOH 滴定不同浓度HCl时的滴定曲线
从表4-9可看出,浓度相差10倍,滴定突跃范围相差两个pH 单位。
表4-9 三种不同浓度的NaOH 溶液分别滴定相应浓度的HCl溶液突跃范围

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




