【摘要】:为了缩小指示剂的变色范围,通常采用混合指示剂。例如,0.1%溴甲酚绿和0.2%甲基红以3∶1体积比混合,颜色变化示意图如下:从上图可看出,当pH<5.1时,溶液呈橙色(黄+红);当pH>5.1时,溶液呈绿色(蓝+黄);pH=5.1时,由于绿色和橙色互补,溶液呈灰色。因而在pH=5.1时,颜色变化非常明显。表4-7列出若干常用酸碱混合指示剂。
如前所述,指示剂的变色范围愈窄愈好,一般酸碱指示剂的变色范围约1.5~2 个pH 单位,这对于反应完全程度较大的滴定体系,如强酸强碱的滴定是适用的,但对某些弱酸弱碱的滴定就显得比较宽了。为了缩小指示剂的变色范围,通常采用混合指示剂。混合指示剂利用颜色之间的互补作用,具有颜色改变较为敏锐、变色范围较狭窄的特点。
混合指示剂可分为两类,一类是由两种或两种以上的酸碱指示剂混合而成的。例如,0.1%溴甲酚绿(变色范围3.8~5.4)和0.2%甲基红(变色范围4.4~6.2)以3∶1体积比混合,颜色变化示意图如下:
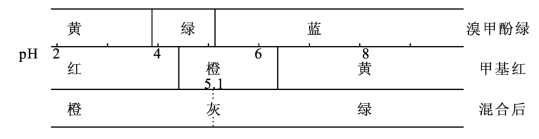
从上图可看出,当pH<5.1时,溶液呈橙色(黄+红);当pH>5.1时,溶液呈绿色(蓝+黄);pH=5.1时,由于绿色和橙色互补,溶液呈灰色。因而在pH=5.1时,颜色变化非常明显。
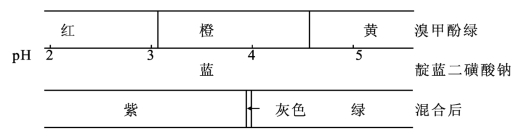
另一类是由一种不随H+浓度变化而改变颜色的惰性染料和另一种指示剂混合而成的。例如,甲基橙和靛蓝二磺酸钠(惰性染料)混合,颜色变化示意图如下:
 (https://www.xing528.com)
(https://www.xing528.com)
由上图可看出,当溶液pH 增大时,单一的甲基橙溶液由红色→橙色→黄色,颜色变化不太敏锐;加上靛蓝二磺酸钠后,溶液由紫色→灰色→绿色,颜色变化非常敏锐。
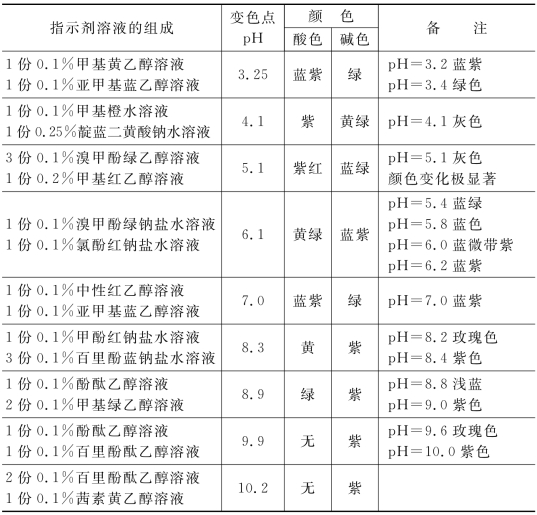
表4-7列出若干常用酸碱混合指示剂。
表4-7 若干常用酸碱混合指示剂
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




