1.温度
温度改变时,指示剂常数KHIn发生变化,因而指示剂的变色范围也发生变化。一般情况下,温度升高,KHIn增大。表4-6列出几种指示剂的变色范围随温度变化的情况。
表4-6 温度对指示剂变色范围的影响
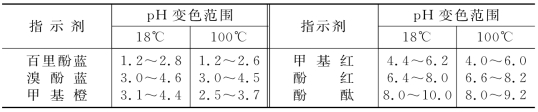
通常滴定是在室温下进行的,如果必须加热,则标准溶液的标定也应在同样条件下进行。
2.指示剂用量
指示剂用量的多少,是一个不容忽视的问题。对于双色指示剂来说(例如甲基橙),指示剂的颜色决定于其酸式和碱式的浓度比〔HIn〕/〔In-〕,设某双色指示剂的分析浓度为c,则它的酸式和碱式的浓度比为:
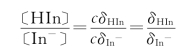
很明显该比值与分析浓度无关,说明指示剂用量并不影响指示剂的变色范围。但用量过多会使色调的变化迟缓,降低指示剂的灵敏性,而且指示剂本身也会消耗一些滴定剂,带来误差。因此在能看清指示剂颜色变化的条件下,一般用量少一点为佳。
对于单色指示剂,用量过多不但使指示剂灵敏性下降,而且对其变色范围也有影响。例如用NaOH 滴定HCl,若以酚酞为指示剂,由无色变成微红,设人眼观察酚酞碱式In-红色的最低浓度为〔In-〕min(mol/L),可以认为是固定不变的。若溶液中指示剂的总浓度为c,则:

由于KHIn和〔In-〕min均为常数,所以c愈大,〔H+〕也愈大,pH 值降低,变色范围向pH 降低的方向移动,终点就会提前。例如,在50~100 mL溶液中加入2~3滴0.1%酚酞,在pH 为9时,即可观察到微红色;而在同样情况下,加入10~15滴0.1%酚酞,则在pH 为8时就出现微红色。因此对于单色指示剂来说,它的用量多少对分析结果影响更大,不容忽视。
3.离子强度
指示剂颜色的变化,受溶液中H+活度的影响,根据指示剂的离解平衡
![]()
活度常数
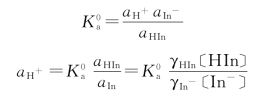
当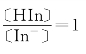 时,即在指示剂理论变色点时:(https://www.xing528.com)
时,即在指示剂理论变色点时:(https://www.xing528.com)
![]()
因为γHIn≈1,故指示剂的理论变色点为:
![]()
根据活度系数近似计算公式:
![]()
可求得指示剂的理论变色点与离子强度的关系:
![]()
可见,增加离子强度时,指示剂的理论变色点向pH 减小的方向移动,这种现象称为酸移。
如果指示剂的离解平衡为
![]()
则
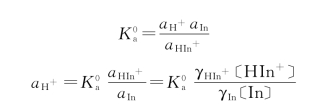
则指示剂的理论变色点与离子强度的关系为:
![]()
指示剂的理论变色点向着pH 增大的方向移动,称为碱移。具有不同电荷的指示剂,其变色点受溶液离子强度的影响不同,它们的pH 是向增大方向还是向减小方向移动,要作具体分析。
4.溶剂的影响
溶剂不仅影响指示剂的溶解度,更重要的是影响指示剂的离解常数,致使指示剂的变色范围发生很大变化,例如,甲基橙在水溶液中p KHIn=3.4,在甲醇溶液中p KHIn=3.8,因此在实际工作中应予注意。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




