1.活度和活度系数
在讨论溶液中的化学平衡时,如果都应用浓度,在某些情况下结论可能与实际情况不符合。为了严格处理化学反应中的许多问题,必须引入活度的概念。
在理想溶液中,各组分(或物种)相互不影响,即它们之间不存在相互作用力,故溶液中各组分的有效浓度(即在化学反应中实际起作用的浓度),只决定于溶液中单位体积内(或单位质量溶剂中)含有的粒子数量,即组分的有效浓度等于组分的真实浓度。
在实际溶液中,由于电解质中的离子与离子之间、离子与溶剂之间存在着相互作用,影响了离子在溶液中的活动性,减弱了离子在化学反应中的作用能力。或者说由于离子间力的影响,离子参加化学反应的有效浓度要比它的真实浓度低。离子在化学反应中起作用的有效浓度称为离子的活度。如果以a 代表离子的活度,c代表其浓度,它们的关系为
![]()
式中γ称为活度系数。
活度系数的大小是衡量实际溶液与理想溶液之间差别的尺度。对于浓度极稀的电解质溶液,离子之间的距离很大,离子之间相互作用力小到可以忽略不计,这时活度系数可以认为等于1,则a=c。随着溶液浓度增大,γ愈小于1,a也愈小于c。
2.活度系数的计算
高浓度的电解质溶液中离子的活度系数,由于情况复杂,还没有较好的定量计算公式。1923年德拜-休克尔(Debye-Hückel)提出了稀溶液(I<0.1 mol/kg)中计算活度系数的公式

式中γi为i种离子的活度系数;Zi为i 种离子的电荷;B 为常数,25℃时为0.328; 。为离子的体积参数,约等于水合离子的有效半径,以0.1 nm为单位;I为溶液中离子的强度。一些离子的
。为离子的体积参数,约等于水合离子的有效半径,以0.1 nm为单位;I为溶液中离子的强度。一些离子的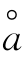 值可由附录表1中查得。
值可由附录表1中查得。
离子强度与溶液中各种离子的浓度及电荷有关,其计算公式为
![]()
式中ci、Zi分别为溶液中i种离子的质量摩尔浓度b(单位为mol/kg)和电荷数。(https://www.xing528.com)
在分析化学中,因浓度一般较稀,此时质量摩尔浓度b近似等于物质的量浓度c mol/L,在有关计算中,直接以c代替b。
在稀溶液中,当I<0.01 时,不需要考虑水合离子的有效半径大小,活度系数可按德拜-休克尔极限公式计算
![]()
在作近似计算时,也可采用此公式。
【例4-1】某溶液含0.050 mol/L KCl和0.10 mol/L HCl,计算溶液中的aH+。
解 溶液中cK+=0.050 mol/L,cCl-=(0.050+0.10)mol/L=0.15 mol/L,cH+=0.10 mol/L
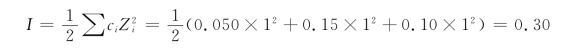
由附表1查得,H+的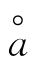 值为9,故
值为9,故
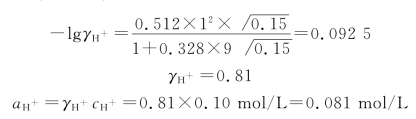
3.中性分子的活度系数
根据德拜-休克尔电解质理论,溶液中的中性分子,由于它们在溶液中不是以离子状态存在的,故在任何离子强度的溶液中,其活度系数均认为是1。实际上并不完全如此,随着溶液中离子强度的增加,许多中性分子的活度系数是有所变化的。不过这种影响一般不大,所以通常都粗略地把中性分子的活度系数视为1。
需要说明的是,在分析化学中,由于通常所遇到的溶液浓度较稀,在准确度要求不太高的情况下,溶液中的平衡处理可不考虑浓度与活度的差别,只有在准确度要求较高的某些计算中(如标准缓冲溶液的pH 计算等)才需要用活度。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




