1.基准物质(基准试剂)
可以用来直接配制标准溶液或标定标准溶液浓度的物质叫基准物质。
作为基准物质必须符合下列条件:
(1)纯度高。杂质含量低于0.02%。
(2)组成(包括结晶水在内)与化学式相符。
(3)性质稳定。在空气中不易被氧化,不易吸收H2O 和CO2,不易失掉结晶水等。
(4)最好具有较大的摩尔质量,以减小称量的相对误差。
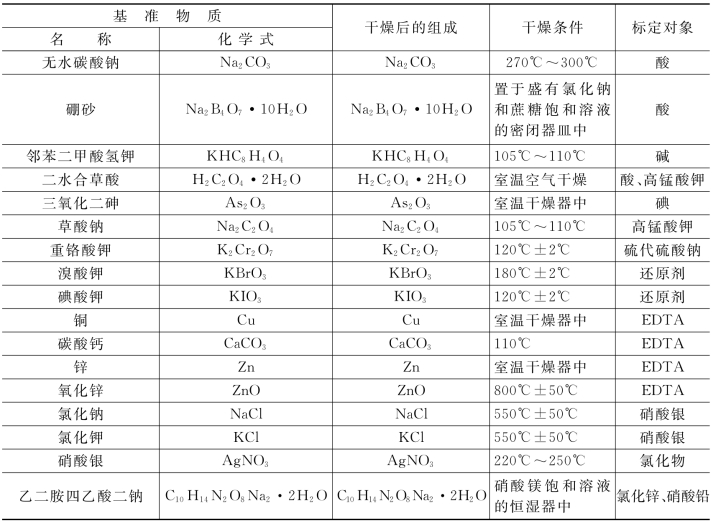
常用的基准物质的干燥条件和应用范围列于表2-5中。
表2-5 常用的基准物质的干燥条件和应用范围
2.标准滴定溶液的制备
已知准确浓度、在滴定分析中常作滴定剂的溶液,称为标准滴定溶液(简称标准溶液)。
(1)标准溶液的制备和标定的一般规定(GB/T 601-2002):
①制备标准滴定溶液的浓度值应在规定浓度值的±5%以内。
②标定标准滴定溶液的浓度时,须两人进行实验,分别各做四平行,每人四平行标定结果的相对极差≤0.15%,两人共八平行标定结果的相对极差≤0.18%。取两人八平行标定结果的平均值为标定结果。在运算过程中保留五位有效数字,浓度值报出结果取四位有效数字。浓度平均值的扩展不确定度一般不大于0.2%。
(2)标准溶液的配制和标定
配制方法:
①直接配制法
当欲配制的标准溶液的溶质是基准物时,可用基准物质直接配制,计算出准确浓度。配制过程如下:(https://www.xing528.com)
基准物质→分析天平→准确称取→适量水溶解→定量转入容量瓶→稀释至刻度→计算出浓度
例,K2Cr2O7的摩尔质量M (K2Cr2O7)=294.18 g/mol,欲配制100 mL 0.100 0 mol/L K2Cr2O7标准溶液,用分析天平准确称取2.941 8 g K2Cr2O7,溶于蒸馏水,定量转入100 mL容量瓶,用水稀释至刻度,摇匀。
但准确称取2.941 8 g试样是不容易做到的,常采取准确称量大致量的试样,称准至0.1 mg,如,称取了2.942 4 g K2Cr2O7,溶解并定容于100 mL 容量瓶中,然后根据所称取的K2Cr2O7的质量、K2Cr2O7的摩尔质量和容量瓶的体积,计算出K2Cr2O7溶液的准确浓度。
②间接配制法
当欲配制的标准溶液的溶质不是基准物时,先粗配成一个近似浓度的溶液,然后用基准物或另一种标准溶液标定,如HCl、NaOH、Na2S2O3、KMn O4等。
粗配(台秤、量筒)→近似浓度→用基准物或标准溶液标定→计算出浓度
【例2-1】若配制0.1 mol/L 的HCl溶液500 mL,问需要取浓度为36%、相对密度为1.2 g/mL的浓HCl多少毫升? (M(HCl)=36.5 g/mol)
解 36%×1.2×V浓HCl=36.5×0.5×0.1
![]()
3.标准溶液浓度的表示方法
(1)物质的量浓度
物质的量浓度简称浓度,符号是C,其定义是:溶液中溶质B 物质的物质的量除以溶液的体积。
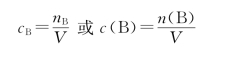
单位:mol/L
由于物质的量浓度是物质的量的导出量,所以凡提到物质的量浓度,也必须指明基本单元,只有指明了基本单元,物质的量浓度才具有意义。例如,为了表示在1 L 溶液中含有0.1 mol的KMnO4溶液的浓度,可根据需要选KMnO4或![]() KMnO4或
KMnO4或![]() KMnO4为基本单元,该溶液的浓度可分别表示成:c(KMn O4)=0.100 0 mol/L或
KMnO4为基本单元,该溶液的浓度可分别表示成:c(KMn O4)=0.100 0 mol/L或![]() =0.300 0 mol/L或
=0.300 0 mol/L或![]() =0.500 0 mol/L。
=0.500 0 mol/L。

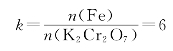
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




