共生菌调节宿主效应免疫细胞亚群的稳态。肠道上皮细胞(intestinal epithelial cells,IECs)不仅在宿主组织中的细胞和免疫细胞之间建立了物理屏障,而且还促进了它们之间的相互作用。上皮稳态或功能的扰动导致肠道疾病的发展,如炎症性肠病(IBD)和结-直肠癌。IECs接收来自共生的信号并产生效应免疫分子。IECs也会影响免疫细胞的功能。
(一)肠道微生物群与免疫系统发育
在肠道中,黏膜免疫细胞在肠相关淋巴样组织中进行抗原特异性适应性免疫应答,或在黏膜固有层(lamina propria,LP)中作为先天和适应性效应细胞的网络积聚。共生细菌控制组织GALT和LP免疫网络的细胞和组织。组织GALT由包含淋巴滤泡的各种大小的解剖结构组成,包括肠系膜淋巴结、派尔集合淋巴结(Peyer's patches,PPs)、孤立淋巴滤泡(isolated lymphatic follicles,ILFs)和隐匿性病灶。当胚胎不存在时,这些淋巴器官的组织在胚胎生活中启动。事实上,无菌(GF)小鼠具有发育不全的PPs和缺乏ILFs的共生细菌定植,诱导幼稚的ILFs(immature ILFS,iILFs)产生,可能是来自密码子,并且它们直到成熟的ILFs(mature ILFs,mILFs),其包含完全组织的B细胞滤泡。有趣的是,这两个步骤的ILF发展似乎是由不同类型的共生菌控制。由此,革兰阴性菌通过含有NOD1(核苷酸结寡聚化结构蛋白1)受体的核苷酸结合寡聚化域诱导ILF的发育,因此,在NOD1缺陷小鼠中不存在ILFs。同时,缺乏适配器蛋白髓样分化因子-88(myeloid differentiation factor 88)或正Toll样受体(positive Toll-like receptor,TRIF)的ILFs由体液免疫中的ILFs产生,而不是在结肠中被阻断,提示这一步骤需要不同的细菌信号来完成。
黏膜免疫系统是高度专门化的,其功能很大程度上独立于免疫系统,并且在肠道细菌定植后经历重大变化。
免疫系统的成熟需要共生微生物,共生微生物“学会”区分共生细菌(几乎变成了准自身和耐受的抗原)和病原细菌。来自小肠上皮细胞和淋巴细胞膜的TLR参与这种差异识别,负责肠黏膜免疫系统的正常发展。TLRs抑制炎症反应的发生,并促进对正常微生物组分的免疫耐受性。TLR的作用是识别不同的一般微生物相关分子模式(MAMP)(包含各种细菌抗原,例如肽聚糖成分-壁酸、荚膜多糖和脂多糖、鞭毛蛋白和未甲基化的细菌DNA Cp G基序),并触发天然肠道免疫。刺激后,启动复杂的信号级联,导致活化B细胞的核因子κB(NF-κB)-轻链增强子的释放,活化B细胞激活编码趋化因子、细胞因子、急性期蛋白质和体液免疫应答的其他效应物的多种基因。TLR活性在生命的最初几周内下降,潜在地允许形成稳定的肠道细菌群落。此外,属于正常肠道微生物群的抗原激活TLR是抑制炎症反应的信号,因此是维持肠内稳态所必需的。作为补充,NOD样受体(nucleotide-binding leucine-rich repeat,NLR,核苷酸结合富含亮氨酸重复序列)识别各种微生物特异性分子并触发炎症小体的组装,炎症小体可作为损伤相关模式的传感器,且与NLPRP6缺乏与免疫应答改变(例如,IL-18水平降低)、生物障碍和肠道增生有关。
胃肠道微生物群已被证明可以调节中性粒细胞的迁移和功能,并影响T细胞群分化为不同类型的辅助细胞(Th),分别为:Th1、Th2和Th17或调节性T细胞(Tregs)。Th17细胞是CD4+T淋巴细胞(辅助T细胞,可以分化为Th细胞和Treg细胞。)的亚群,可分泌多种细胞因子(IL-22、IL-17A和IL-17F),对免疫稳态和炎症反应有显著影响。与分化后具有稳定分泌谱的Th1和Th2细胞不同,Th17细胞保留着不同的细胞因子表达谱和功能。研究表明,从共生细菌脆性芽孢杆菌中提取纯化的荚膜多糖可以抑制IL-17的产生,保护结肠黏膜免受细菌抗原引起的炎症反应,刺激CD4+T淋巴细胞产生IL-10。另外,结肠环境也刺激来自幼稚CD4+T淋巴细胞的外周衍生调节性T细胞的新生分化和扩增。Treg是免疫耐受的关键介质,限制不适当的高炎症反应,其功能障碍导致自身免疫障碍发生。
(二)黏膜免疫球蛋白(IgA)产生
IgA的产生和分泌进入肠腔是肠免疫的特征。IgA由肠相关淋巴组织(gut-associated lymphatic tissue,GALT)和LP B细胞产生,并通过IECs作为分泌型IgA(SIgA)转运到肠腔中。大多数SIgA在管腔中被识别和调理细菌,从而阻止其进入LP。IgA是由肠道-T细胞依赖和T细胞独立的两种机制诱导。GALT在这两种情况下都很重要。T细胞依赖性IgA诱导发生在PPs的生发中心。GALT的成熟,如上所述,需要共生细菌,IgA的产生也可以依赖于微生物的存在。一种替代的T细胞独立的IgA诱导途径依赖于由IECs产生的B细胞激活的细胞因子来响应共生信号。但即使在LP中存在B细胞,GF小鼠的IgA产量也受损。至目前为止不同的共生细菌诱导IgA的能力尚未被系统研究。然而,有报道并非所有的共生细菌都能诱导IgA的产生。在单克隆GF小鼠的结肠GntoBoiT实验中发现,分节丝状杆菌(Sectional filamentous bacilli,SFB)诱导IgA,但梭状芽孢杆菌的混合物不诱导IgA产生。IgA诱导也可以依赖于解剖位置。例如,在单核化的GF小鼠中,拟杆菌类杆菌在结肠mILF中诱导IgA,而在回肠中不诱导IgA。根据革兰阴性细菌,如酸化拟杆菌(Bacteroides acidifaciens)诱导的NOD1依赖性mILF,而不是革兰阳性的约翰逊乳酸杆菌(Lactobacillus johnsonii)诱导在GALT的生发中心生成IgA。同时,黏膜相关细菌,如SFB,可改变IEC功能以诱导生成IgA。此外,黏膜相关细菌,如SFB,可改变IECs功能以诱导IgA产生。对共栖反应的调理SIgA的分泌可以被认为是病原体保护黏膜的一种机制(图1-1,见彩图)。
(三)先天免疫细胞
先天免疫细胞在功能上与微生物及其产物之间有非常密切的联系,因此,共生细菌预期会影响先天免疫细胞的发育或功能。在某些情况下,肠道先天免疫亚群的研究一直难以调和,可能是由于隔离这些细胞的困难所致,隔离程序的差异也由于缺乏可靠的体内遗传消融模型来研究它们的功能。然而,似乎树突状细胞(DC)、巨噬细胞(macrophage,MP)、自然杀伤(natural killer,NK)细胞或先天性淋巴样细胞(innate lymphoid cells,ILCs)的发育一般不需要共生细菌。一些研究已经报道了GF小鼠中DC或ILC数的差异,一般而言,所有主要的先天免疫亚群都存在于GF小鼠中。这似乎是共生信号的控制,是先天免疫细胞的效应器功能。DCs和MPs可诱导抗炎细胞因子的产生,例如IL-6、IL-23、TGF-β、IL-10,可被不同类型的共生体诱导。IL-22产生的ILCs介导了许多肠道稳态功能,似乎也受到来自共生信号的控制,尽管这种控制的方向还是一个有争议的问题。微生物菌群的直接或间接效应在各种情况下都是一个重要的问题。直接效应是由固有免疫细胞直接检测共生产物的结果,例如DPs多功能处理系统在PPs或DCs采样管腔内容中的检测。相反,共生间接介导NK细胞功能。尽管NK细胞数目在GF小鼠中是正常的,但它们在抗病毒活性上功能不足。NK细胞启动需要干扰素,并且表明NK细胞启动缺陷是缺乏共生的DCs产生Ⅰ型干扰素的间接效应。同样地,共生诱导的IL-25上皮表达间接控制ILCs产生IL-22。
(四)T细胞与T细胞稳态(https://www.xing528.com)
肠黏膜中多个效应T细胞亚群之间的平衡称为T细胞稳态。这种平衡的维持和不同效应T细胞亚群直接维持了健康的免疫状态和肠道疾病的进展。一些已知的共同免疫调节效应的例子发生在T细胞稳态的水平上,并且共生体的存在影响肠道中几乎所有的T细胞亚群的发育或功能。
(五)上皮内淋巴细胞
上皮内淋巴细胞(intraepithelial lymphocyte,IELs)是位于肠上皮层的肠T细胞的独特子集,因此与LP淋巴细胞物理分离。与LP T细胞相比,IEL富含T细胞受体(T cell receptor,TCR)γδ细胞以及CD8+细胞,它们也含有独特的CD8+α+细胞群。目前对IEL的发展和功能还没有完全了解,但是在空间上它们很好地接收来自共栖和IECs的信号。IELs促进上皮屏障功能,有助于清除感染或受损的IECs的细胞毒活性,并从IECs诱导产生抗菌肽。因此,存在一个恒定的上皮内淋巴细胞-肠道上皮细胞之间的相互作用。事实上,TCRαβ+IEL对传统的主要组织相容性复合体(MHC)肽配体没有反应,但对IECs大量表达的配体,如CD8-α+IELs的胸腺白血病抗原配体有反应。除了影响IEC功能外,IELs还具有调节功能和抑制作用。动物模型中见有炎症反应。TCRγδIEL已被证明产生AMP(antimicrobial peptides,抗菌肽)。共生细菌的存在影响IELs的发育和功能。在GF小鼠中,TCRαβ+IELs几乎不存在,TCRγδIELs对细胞功能有损害。TCRγδIEL的产生也依赖于共生细菌的存在。IEL稳态的共生调控似乎依赖于共生类型。共生细菌的组成可以通过控制各种IEL子集的丰度和功能来控制IEL。这种分子和细胞机制仍有待阐明,但可能涉及通过IECs的传递信号。
(六)固有层CD4T细胞稳态
在LP中,CD4 TCRαβT细胞是主要的T细胞类型。稳定状态下,在无特定的病原体小鼠菌落中,LP中最丰富的两种效应CD4 T细胞类型是产生IL-17的Th17细胞和Treg。这两个亚群都是异质的,但一般来说,Th17细胞促进炎性保护性免疫反应,Tregs抑制过度或不需要的免疫激活,因此具有一般的抗炎功能。这两个功能拮抗子集之间的平衡建立了LP中的免疫状态。它也代表了控制共生体微生物群组成的一个实例。
在特定的无病原体小鼠中,Th17细胞在稳定状态下是丰富的,但在GF小鼠中几乎不存在。此外,GF小鼠也缺乏某些系统性Th17细胞应答,例如在猴子的实验性自身免疫性脑脊髓炎动物模型(experimental autoimmune encephalomyelitis,EAE模型)中产生脑源性Th17细胞的脑浸润。因此共生细菌需要黏膜Th17细胞诱导,而Th17细胞的存在依赖于微生物组成。在无菌小鼠研究中,80个不同的共生菌株中,SFB是唯一能诱导淋巴滤泡细胞中高水平Th17细胞的共生体。通过SFB诱导Th17细胞也不需要额外的共生菌。因此SFB是共生物种,其存在是诱导黏膜Th17细胞的作用。SFB诱导Th17细胞的分子和细胞机制目前尚不清楚。然而,与大多数其他共栖相比,SFB直接与IECsR的相互作用,且SFB具有多种上皮效应。
Treg存在于所有的外周组织中,它们提供免疫抑制和下调过度的炎症反应。它们在整个胃肠道中富集。Treg在结肠中尤其富集,占40%~50%的CD4 T细胞。Treg在肠相关淋巴组织中的诱导不依赖于共生信号,因为Treg在GF小鼠的体液免疫中存在相似甚至富集存在,并且具有不受干扰的功能。相比之下,GF小鼠在结肠中含有3~4倍的Foxp3+(叉状头转录因子,是Treg细胞系的主要调节因子)Treg,并且来自非GF小鼠的粪便微生物的定植可恢复Treg的数值。因此,结肠Treg受共生驱动信号的调控。在Th17细胞的情况下,并非所有共生细菌都能诱导结肠Tregs。结果表明,用梭菌属Ⅳ和いa相混合的原生动物共生菌的定植足以完全恢复GF结肠中的Treg水平。在特定的无病原体小鼠中,这些梭状芽孢杆菌优先在它们所在的结肠定居。黏液层又靠近IECs。在人类中发现,梭菌群的成员和IL-10的诱导与大肠菌群的保护作用有关。腔中细菌也可能影响Treg的功能,例如,脆弱芽孢杆菌诱导IL-10产生,并增加Foxp3+Treg的抑制和抗炎功能。
不同的共生菌诱导或修饰CD4 T细胞亚群功能的能力具有重要的功能性后果。这表明这些免疫调节共刺激物的相对丰度可以决定LP CD4 T细胞的组成。此外,LP CD4 T细胞室的组成指示适应性免疫应答的性质和强度。事实上,SFB定植与小鼠、大鼠和兔肠道感染的保护有关,且Treg诱导梭菌的定植增加了对结肠炎和全身IgE应答的抵抗力。
(七)不变的自然杀伤T细胞
不变的NKT(invariant natural killer T cell,iNKT)细胞是先天的T细胞,它表达恒定的TCRs并响应非经典MHC-Ⅰ分子所呈现的糖脂,在对微生物感染和肿瘤的第一线反应中,iNKT细胞具有不同的功能,但是,与Th17细胞相似,也可以控制结肠炎、类风湿关节炎和哮喘的自身免疫性炎症。iNKT细胞的发育和功能受共生微生物的调控。在GF小鼠中,在结肠和肺黏膜中观察到iNKT细胞升高,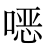 唑酮诱导的结肠炎和过敏性哮喘导致易感性和发病率增加。在新生期用常规微生物菌群对GF小鼠进行定植,通过降低黏膜iNKT细胞水平发现对自身免疫有预防作用,但是成年GF小鼠的定植对iNKT细胞和疾病易感性没有影响。此外,共生菌在iNKT的积累作用取决于上皮驱动信号。微生物组分降低黏膜iNKT细胞水平的作用在研究中没有被检测。然而,不同的共生细菌对系统性iNKT细胞的水平和功能的影响已被报道。与黏膜iNKT细胞相比,全身性的iNKT细胞功能似乎需要鞘氨醇单胞菌,它携带由CD1产生的抗原鞘糖脂产物。今后需要进一步研究共生细菌对iNKT细胞发育和维持的详细分子机制和时空调控上的作用。
唑酮诱导的结肠炎和过敏性哮喘导致易感性和发病率增加。在新生期用常规微生物菌群对GF小鼠进行定植,通过降低黏膜iNKT细胞水平发现对自身免疫有预防作用,但是成年GF小鼠的定植对iNKT细胞和疾病易感性没有影响。此外,共生菌在iNKT的积累作用取决于上皮驱动信号。微生物组分降低黏膜iNKT细胞水平的作用在研究中没有被检测。然而,不同的共生细菌对系统性iNKT细胞的水平和功能的影响已被报道。与黏膜iNKT细胞相比,全身性的iNKT细胞功能似乎需要鞘氨醇单胞菌,它携带由CD1产生的抗原鞘糖脂产物。今后需要进一步研究共生细菌对iNKT细胞发育和维持的详细分子机制和时空调控上的作用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




