(一)实验目的
(1)了解用吸收法净化废气中SO2的原理和效果。
(2)改变空塔速度,观察填料塔内气液接触状况和液泛现象。
(3)掌握测定填料吸收塔的吸收效率及压降的方法。
(4)测定化学吸收体系(碱液吸收SO2)的体积吸收系数。
(二)实验设备及特点
废气的吸收净化工艺是大气污染控制中最为基础与重要的环节之一,其设备按气液接触基本构件特点,可分为填料塔、板式塔和特种接触塔三大类。
本实验采用填料吸收塔,用5%NaOH或Na2CO3溶液吸收SO2。通过实验可进一步了解用填料塔吸收净化有害气体的方法,同时还有助于加深理解在填料塔内气液接触状况及吸收过程的基本原理。
设备特点如下:
(1)可模拟进行小试烟气脱硫实验。
(2)可测定研究处理风量、待处理气体浓度对吸收效率及压力损失的影响。
(3)配有微电脑气体浓度检测系统(能在线监测进口处与出口处气体浓度的变化,并具有数据采集与打印输出功能)。
(4)装置配有微电脑风量、风压检测系统(能在线监测各段的风压、风速、风量,并具有数据采集与打印输出功能)。
(5)设备带有配气装置(包括废气流量计、SO2钢瓶等),配气浓度可精确控制调节。
(6)设备配有气体混合系统,使风管内的气体分布均匀、取样检测更精确。
(7)处理风量、进气浓度等可自行调节。
(8)该装置可在线数据采集,也可用备用数据采集接口,设备系统还在净化设备前后配有人工采样口。
(9)能直接观察到气液接触状况与液泛现象,吸收效率高,实验性强。
(三)技术条件与指标
(1)动力装置布置为负压式。
(2)塔径:Φ100mm。
(3)塔高:800mm。
(4)板间距:400mm。
(5)SO2进气浓度:0.1%~0.5%。
(6)空塔气速:0.5~1.2m/s。
(7)压力损失:500Pa。
(8)液气比:1~10L/m3。
(9)喷淋密度:6~8m3/(m2·h)。
(10)雾沫夹带:小于7%。
(11)处理气量:约25m3/h。
(12)吸收效率:约80%。
(13)填料:Φ25mm空心多面球。
(14)塑料混合缓冲罐:0.5m3。
(15)电源380V,三相四线制,功率1500W。
(16)环境温度:5~40℃。
(四)实验原理
含SO2的气体可采用吸收法净化。由于SO2在水中溶解度不高,常采用化学吸收法。吸收SO2的吸收剂种类较多,本实验采用NaOH或Na2CO3溶液作为吸收剂,吸收过程发生的主要化学反应为:
2NaOH+SO2—→Na2SO3+H2O
Na2CO3+SO2—→Na2SO3+CO2
Na2SO3+SO2+H2O—→2NaHSO3
本实验过程中通过测定填料吸收塔进、出口气体中SO2的含量,即可近似计算出吸收塔的平均净化效率,进而了解吸收效果。气体中SO2含量的测定可采用碘量法或SO2测定仪。
本实验中通过测出填料塔进、出口气体的全压,即可计算出填料塔的压降;若填料塔的进出口管道直径相等,用U形管压差计测出其静压差即可求出压降。对于碱液吸收SO2的化学吸收体系,还可通过实验测出体积吸收系数。
(五)实验流程、仪器设备和试剂
1.实验流程
吸收液从贮液槽由水泵并通过转子流量计,由填料塔上部经喷淋装置喷入塔内,流经填料表面由塔下部排出,回入贮液槽。空气由高压离心风机与SO2气体相混合,配制成一定浓度的混合气。SO2来自钢瓶,并经流量计计量后进入进气管。含SO2的空气从塔底部进气口进入填料塔内,通过填料层后,气体经除雾器后由塔顶排出。
2.仪器设备
配套实验装置有:
(1)微电脑尾气浓度检测系统1套。
(2)微电脑在线风量检测系统1套。
(3)微电脑在线风压检测系统1套。
(4)微电脑在线风速检测系统1套。
(5)微电脑在线温度、湿度检测系统1套。
(6)大屏幕9英寸液晶显示器1套。
(7)数据处理分析系统1套。
(8)计算机接口1个与配套软件1套。
(9)系统在线温度湿度检测装置1套。
(10)SO2配气系统1套(包括废气流量计1只、SO2气体与钢瓶1套等)。
(11)贮液箱1个。
(12)耐腐泵1台。
(13)液体转子流量计1个。
(14)加药口1个。
(15)取样监测口2个。
(16)风量调节装置1套。
(17)气体整流板1套。
(18)气体混合系统1套。
(19)静压测口2个。
(20)折板除雾器1套。
(21)高压离心风机1台。
(22)小型仪表控制柜1个。
(23)不锈钢实验台架1套。
(24)连接管道、阀门及电器开关等1套。
整体外形尺寸:长2200mm×宽500mm×高2100mm。
本实验需自行配备以下仪器:
(1)温度计(0~100℃)2支。
(2)空盒式大气压力计1支。
(3)玻璃筛板吸收瓶(125mL)20个。
(4)锥形管(250mL)20个。
(5)烟气测试仪(采样用)2台。
(6)或综合烟气分析仪2台。
3.试剂
(1)采样吸收液 取11g氨基磺酸铵、7g硫酸铵,加入少量水,搅拌使其溶解,继续加水至1000mL,用硫酸[c(H2SO4)=0.05mol/L]和氨水[c(NH3·H2O)=0.1mol/L]调节pH至5.4。
(2)碘贮备液[c(I2)=0.05mol/L]称取12.7g碘放入烧杯中,加入40g碘化钾,加25mL水,搅拌至全部溶解后,用水稀释至1L,贮于棕色试剂瓶中。
标定:准确吸取25mL碘贮备液,以硫代硫酸钠溶液[c(Na2S2O3)=0.1mol/L]滴定,溶液由红棕色变为淡黄色后,加5mL5%淀粉溶液,继续用硫代硫酸钠溶液滴定至蓝色恰好消失为止,记下滴用量,则:
式中 c(I2)——碘溶液的实际浓度,mol/L
c(Na2S2O3)——硫代硫酸钠溶液实际浓度,mol/L
V——消耗硫代硫酸钠溶液的体积,mL
(3)碘溶液[c(I2)=0.005mol/L]准确吸取100mL碘贮备液[c(I2)=0.05mol/L]于1000mL容量瓶中,用水稀释至标线,摇匀,贮于棕色瓶内,保存于暗处。(https://www.xing528.com)
(4)硫代硫酸钠溶液[c(Na2S2O3)]取26g硫代硫酸钠(Na2S2O3·5H2O)和0.2g无水碳酸钠于1000mL新煮沸并冷却了的水中,加10mL异戊醇,充分混匀,贮于棕色瓶中。放置3d后进行标定。若浑浊,应过滤。
标定:将碘酸钾(优级纯)于120~140℃干燥1.5~2h,在干燥器中冷却至室温。称取0.9~1.1g(准确至0.1mg)溶于水中,移入250mL容量瓶中,稀释至标线,摇匀。吸取25mL此溶液,于250mL碘量瓶中,加2g碘化钾,溶解后,加10mL盐酸[c(HCl)=2mol/L]溶液,轻轻摇匀。于暗处放置5min,加75mL水,以硫代硫酸钠溶液[c(Na2S2O3)=0.1mol/L]滴定。至溶液为淡黄色后,加5mL淀粉溶液,继续用硫代硫酸钠溶液滴定至蓝色恰好消失为止,记下消耗量(V)。
另外取25mL蒸馏水,以同样的条件进行空白滴定,记下消耗量(V0)。
硫代硫酸钠溶液浓度可用下式计算:
式中 c(Na2S2O3)——硫代硫酸钠溶液实际物质的量浓度,mol/L
W——碘酸钾的质量,g
V——滴定消耗的硫代硫酸钠溶液的体积,mL
V0——滴定空白溶液消耗的硫代硫酸钠溶液的体积,mL
214——碘酸钾相对分子质量
(5)0.5%淀粉溶液 取0.5g可溶性淀粉,用少量水调成糊状,倒入100mL煮沸的饱和氯化钠溶液中,继续煮沸直至溶液澄清(放置时间不能超过1个月)。
(6)5%烧碱或纯碱溶液 称取工业用烧碱或纯碱5kg,溶于100L水中。作为吸收系统的吸收液。
(六)实验方法和步骤
(1)正确连接实验装置,并检查系统是否漏气,并在贮液槽中注入配制好的5%的碱溶液。
(2)在玻璃筛板吸收瓶内装入采样用的吸收液50mL。
(3)打开吸收塔的进液阀,并调节液体流量,使液体均匀喷淋,并沿填料表面缓慢流下,以充分润湿填料表面,当液体由塔底流出后,将液体流量调节至200L/h左右。
(4)打开高压离心风机,调节气体流量,使塔内出现液泛。仔细观察此时的气液接触状况,并记录液泛的气速。
(5)逐渐减小气体流量,在液泛现象消失后,即在接近液泛现象、吸收塔能正常工作时,开启SO2气瓶,并调节其流量,使气体中SO2的含量为0.01%~0.5%(体积分数)。
(6)经数分钟,待塔内操作完全稳定后,按表3-9的要求开始测量并记录有关数据。
(7)在吸收塔的上下取样口用烟气测试仪(或综合烟气分析仪)同时采样。采样时,先将装入吸收液的吸收瓶放在烟气测试仪的金属架上。吸收瓶和玻璃筛板相连的接口与取样口相连;吸收瓶另一接口与烟气测试仪的进气口相连,注意不要接反。然后,开启烟气测试仪,以0.5L/min的采样流量采样5~10min(视气体中的SO2浓度大小而定)。取样2次。
(8)在液体流量不变,并保持气体中SO2浓度在大致相同的情况下,改变气体的流量,按上述方法,测取4~5组数据。
(9)实验完毕后,先关掉SO2气瓶,待1~2min后再停止供液,最后停止鼓入空气。
(10)样品分析。将采过样的吸收瓶内的吸收液倒入锥形瓶中,并用15mL吸收液洗涤吸收瓶2次,洗涤液并入锥形瓶中,加5mL淀粉溶液,以碘溶液[c(I2)=0.005mol/L]滴定至蓝色,记下消耗量(V),另取相同体积的吸收液,进行空白滴定,记下消耗量(V0),并将结果填入表3-9中。
(七)实验数据的记录和处理
(1)气体温度和含湿量的测定 由于系统吸入的是室内空气,所以近似用室内空气的温度和湿度代表管道内气流的温度ts和湿度yw。由挂在室内的干湿球温度计测量的干球温度和湿度温度,可查得空气的相对湿度Ф,由干球温度可查得相应的饱和水蒸气压力pv,则空气所含水蒸气的体积分数:
式中 pv——饱和水蒸气压力,kPa
pa——当地大气压力,kPa
(2)管道中各点气流速度的测定 本实验用测压管和U形管压力计(或倾斜微压计)测定管道中各测点的动压pk和静压ps。各点的流速按下式计算:
式中 Kp——皮托管的校正系数
pK——各点气流的动压,Pa
ρ——测定断面上气流的密度,kg/m3
气流的密度可按下式计算:
式中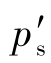 ——测定断面上气流的平均静压(绝对压力),
——测定断面上气流的平均静压(绝对压力),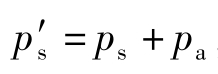 ,kPa
,kPa
ps——气流的平均静压(相对压力),kPa
Ts——气体(即室内气体)温度,K
(3)管道中气体流量的测定 根据断面平均流速计算:根据各点流速可求出断面平均流速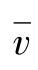 ,则气体流量:
,则气体流量:
式中 A——管道横断面积,m2
用静压法测定:根据测得的吸气均流管入口处的平均静压的绝对值|ps|,并算出气体流量:
式中|ps|——均流管处气流平均静压的绝对值,Pa
φ——均流管的流量系数
标准状态下(273.15K 101.33kPa)的干气体流量:
(4)由样品分析数据计算标准状态下气体中SO2的浓度:
式中 ρ(SO2)——标准状态下二氧化硫浓度,mg/m3
c(I2)——碘溶液摩尔质量浓度,mol/L
V——滴定样品消耗碘溶液的体积,mL
V0——滴定空白消耗碘溶液的体积,mL
64——SO2的相对分子质量
VNd——标准状态下的采样体积,L
V Nd可用下式计算:
式中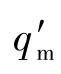 ——采样流量,L/min
——采样流量,L/min
t——采样时间,min
Tm——流量计前气体的绝对温度,K
pm——流量计前气体的压力,kPa
Ba——当地大气压力,kPa
(5)吸收塔的平均净化效率(η)可由下式近似求出:
式中 C1——标准状态下吸收塔入口处气体中SO2的质量浓度,mg/m3
C2——标准状态下吸收塔出口处气体中SO2的质量浓度,mg/m3
(6)吸收塔压降(Δp)的计算:
式中 p1——吸收塔入口处气体的全压或静压,Pa
p2——吸收塔出口处气体的全压或静压,Pa
(7)气体中SO2的分压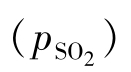 的计算:
的计算:
式中 ρ——标准状态下气体中SO2的质量浓度,mg/m3
32——SO2的相对分子质量
p——气体的总压,Pa
(8)体积吸收系数的计算 以浓度差为推动力的体积吸收系数(Kra)可通过下式计算:
式中 Q——通过填料塔的气体量,kmol/h
h——填料层高度,m
A——填料塔的截面积,m2
y1,y2——进出填料塔气体中SO2的摩尔分数
Δym——对数平均推动力,可由下式计算:
对于碱液吸收SO2系统,其吸收反应为极快不可逆反应,吸收液面上SO2平衡浓度y*可看作零,则对数平均推动力(ym)可表示为:
由于实验气体中SO2浓度较低,则摩尔分数y1、y2可用下式表示:
式中 pA1、pA2——进出塔气体中SO2的分压力,Pa
p——吸收塔气体的平均压力,Pa
将式(3-42)和式(3-43)代入式(3-40)中,可得到以分压差为推动力的体积吸收系数(KGa)的计算式。
式中 h——填料层高度,m
(9)实验数据记录 将实验测得数据和计算的结果等填入表3-9~表3-11中。
实验时间__________年__________月__________日 实验小组人员__________
大气压力__________kPa 室温__________℃ 液泛气速__________m/s
根据实验结果,以空塔气速为横坐标,分别以吸收效率和压降为纵坐标,绘出曲线。
(八)讨论(讨论结果写入实验报告中)
(1)从实验结果标绘出的曲线,可以得出哪些结论?
(2)本实验中还存在什么问题?应做哪些改进?
(3)还有哪些比本实验中的脱硫方法更好的脱硫方法吗?
表3-9 实验系统测定结果记录表
表3-10 气体浓度测定记录表
表3-11 实验结果汇总表
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




