1.氧化反应
点燃纯净的乙炔,火焰明亮,带有浓烟,燃烧时火焰温度很高(>3 000℃),可用于气焊和气割。其火焰称为氧炔焰。
![]()

图6-21 甲烷、乙烯、乙炔燃烧对比
乙炔也能被KMnO4氧化,使紫色酸性高锰酸钾溶液褪色,可用于乙炔和甲烷的鉴别。
观察思考
甲烷、乙烯和乙炔的燃烧情况有什么不同?为什么?
2.加成反应
将乙炔通入溴水或Br2的CCl4溶液,会使溴水或Br2的CCl4溶液褪色。这是由于乙炔中含有不饱和键,使其和Br2发生了加成反应(addition reaction)。
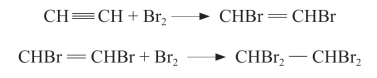
乙炔除了与溴能发生加成反应外,在一定条件下还可以与氢气、氯化氢等发生加成反应。

3.聚合反应
由于乙炔与乙烯都是不饱和烃,所以化学性质基本相似,都可以发生聚合反应(polymerization reaction)。在适宜条件下,三分子乙炔能聚合成一分子苯(C6H6)。但苯的产量不高,副产物也多。
4.金属取代反应
连接在C≡C键上的碳原子上的氢原子相当活泼,易被金属取代,生成炔烃金属衍生物,这类化合物叫作炔化物。
反应1:将乙炔通入溶有金属钠的液氨里有氢气放出。
反应2:乙炔与银氨溶液反应,产生白色乙炔银沉淀。(https://www.xing528.com)
反应3:将乙炔通入硝酸银或氯化亚铜氨水溶液,立即生成白色乙炔银(AgC≡CAg)和棕红色乙炔亚铜(CuC≡CCu)沉淀(可用于乙炔的定性鉴定)。
以上现象的发生,是由于炔烃中C≡C键的存在,C原子对H原子的束缚力较弱,从而使得H原子比较容易解离,显示“酸性”。
【注意】在干燥乙炔银和乙炔亚铜这两种金属炔化物时,受热或受到撞击容易发生爆炸,上述反应完成后需要用盐酸或硝酸处理乙炔银和乙炔亚铜,使之分解,以免发生危险。所以,乙炔在使用和贮运中要避免与银、铜接触。
5.安全与防护
呼吸系统防护:一般不需要特殊防护,但建议蒸气浓度不明等特殊情况下佩带合适的自吸过滤式防毒面具。
眼睛防护:一般不需要特殊防护,高浓度接触时可戴化学安全防护眼镜。
身体防护:穿防静电工作服。
手防护:戴一般作业防护手套。
其他防护:工作现场严禁吸烟。避免长期反复接触,进入罐、限制性空间或其他高浓度区作业,必须有人监护。
有害燃烧产物:一氧化碳、二氧化碳。
灭火方法:切断气源。若不能切断气源,则不允许熄灭泄漏处的火焰。喷水冷却容器,可能的话将容器从火场移至空旷处。
灭火剂:雾状水、泡沫、二氧化碳、干粉。
资料在线
炔 烃
炔烃是分子中含有碳碳三键(C≡C)的碳氢化合物的总称,是一种不饱和的碳氢化合物,简单的炔烃化合物有乙炔(C2H2)、丙炔(C3H4)等。炔烃在水中的溶解度比烷烃、烯烃的稍大。
由于含有碳碳三键,炔烃不稳定、非常活跃,与空气混合,遇明火、高热极易引起燃烧爆炸。
炔烃具有与乙炔基本相同的化学性质,与氧化剂接触猛烈反应,与氟、氯等接触会发生剧烈的化学反应,能与铜、银、汞等的化合物生成爆炸性物质。因此,禁止将炔烃与强氧化剂、强酸、卤素接触,禁止受热。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




